2018-2019年高一上册第二次月考化学考题同步训练(浙江省温州市求知中学)
| 1. 选择题 | 详细信息 |
|
下列物质属于盐的是( ) A. Cu2(OH)2CO3 B. Na2O C. Mg(OH)2 D. CH3CH2OH |
|
| 2. 选择题 | 详细信息 |
|
下列属于碱性氧化物的是 A. HCl B. CO2 C. CaO D. KOH |
|
| 3. 选择题 | 详细信息 |
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是 ( )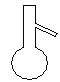  A. 蒸馏、蒸发、分液、过滤 B. 蒸馏、过滤、分液、蒸发 C. 分液、过滤、蒸馏、蒸发 D. 过滤、蒸发、分液、蒸馏 |
|
| 4. 选择题 | 详细信息 |
|
用NA表示阿伏德罗常数,下列叙述正确的是 A. 标准状况下,22.4LH2O含有的分子数为1 NA B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA C. 通常状况下,1 NA 个CO2分子占有的体积为22.4L D. 物质的量浓度为0.5mol·/L的MgCl2溶液中,含有Cl-个数为1 NA |
|
| 5. 选择题 | 详细信息 |
|
下列反应属于四种基本反应类型,但不属于氧化还原反应的是( ) A. Fe+CuSO4═FeSO4+Cu B. CO+CuO C. AgNO3+NaCl═AgCl↓+NaNO3 D. 2FeCl2+Cl2═2FeCl3 |
|
| 6. 选择题 | 详细信息 | |||||||||||||||||||||||||
下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
|
||||||||||||||||||||||||||
| 7. 选择题 | 详细信息 |
|
下列实验操作中错误的是( ) A. 蒸发操作时,当大部分固体析出时就停止加热,利用余热把剩下的水蒸干 B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
|
| 8. 选择题 | 详细信息 |
|
某阴离子X2﹣有m个电子,其质量数为a,则核内中子数为( ) A. m+2 B. m+5 C. a﹣m+2 D. a﹣m﹣2 |
|
| 9. 选择题 | 详细信息 |
|
下列溶液中的Cl-浓度与50mL 1mol•L﹣1MgCl2溶液中的Cl-浓度相等的是( ) A. 150 mL 1 mol•L﹣1 NaCl溶液 B. 75 mL 2 mol•L﹣1 CaCl2溶液 C. 150 mL 2 mol•L﹣1 KCl溶液 D. 75 mL 1 mol•L﹣1 AlCl3溶液 |
|
| 10. 选择题 | 详细信息 |
|
实验室保存下列物质的方法中,不正确的是 A. 少量金属钠保存在煤油里 B. 烧碱溶液盛装在用玻璃塞塞紧的试剂瓶中 C. FeSO4溶液存放在加有少量铁粉的试剂瓶中 D. 氯水应装在棕色瓶中密封避光保存 |
|
| 11. 选择题 | 详细信息 |
|
下列电离方程式中书写正确的是( ) A. NaHSO4 C. HClO=H++ClO﹣ D. MgCl2═Mg2++2Cl﹣ |
|
| 12. 选择题 | 详细信息 |
|
下列各组离子能在溶液中大量共存的是( ) A. Na+、K+、Cl﹣、SO42﹣ B. Na+、H+、CO32﹣、Cl﹣ C. Na+、Ca2+、NO3﹣、CO32﹣ D. K+、H+、SO42﹣、OH﹣ |
|
| 13. 选择题 | 详细信息 | ||||||||||||||||||||
检验下列物质的试剂、现象都正确的是( )
|
|||||||||||||||||||||
| 14. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 常温下,浓硫酸可以用铁制槽罐存放,说明铁与浓硫酸不反应 B. 检验氯化氢中是否混有氯气,可采用湿润的有色布条 C. 镁在空气中燃烧只生成氧化镁 D. 钠可以从硫酸铜溶液中置换出金属铜 |
|
| 15. 选择题 | 详细信息 |
|
下列有关于Cl2的说法中,错误的是 A. Cl2是一种黄绿色、密度比空气大的有毒气体 B. 红热的铁丝在Cl2中剧烈燃烧,产生白色烟雾 C. 工业上用Cl2和石灰乳为原料制造漂白粉 D. Cl2能与水反应生成盐酸和次氯酸 |
|
| 16. 选择题 | 详细信息 |
|
下列化学反应的离子方程式正确的是( ) A. 用小苏打治疗胃酸过多:HCO3﹣+H+=CO2↑+H2O B. 往碳酸镁中滴加稀盐酸:CO32﹣+2H+=CO2↑+H2O C. 往氨水中滴加氯化镁溶液:Mg2+2OH﹣=Mg(OH)2↓ D. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42﹣+H++OH﹣=BaSO4↓+H2O |
|
| 17. 选择题 | 详细信息 |
用图所示实验装置(夹持仪器己略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )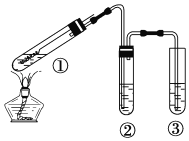 A. 上下移动①中铜丝可控制SO2的产生与停止 B. ②中选用品红溶液验证SO2的生成 C. ③中选用NaOH溶液吸收多余的SO2 D. 为确认有CuSO4生成,向①中加水,观察颜色 |
|
| 18. 选择题 | 详细信息 |
|
下列说法不正确的是 A. 氯气可用于合成药物 B. 碳酸钠可用于治疗胃酸过多 C. 高压钠灯常用来广场照明 D. 镁合金密度小强度大可用于制飞机零部件 |
|
| 19. 选择题 | 详细信息 |
|
下列说法中不正确的是 A. 氟化银可用于人工降雨 B. 从海水中获取食盐不需要化学变化 C. FeCl3溶液可用于制作印刷电路板 D. 绿矾可用来生产铁系列净水剂 |
|
| 20. 选择题 | 详细信息 |
|
下列数字代表各元素的原子序数,则各组中相应的元素能形成XY2型离子化合物的是( ) A. 3和8 B. 1和16 C. 12和17 D. 6和16 |
|
| 21. 选择题 | 详细信息 |
|
下列有关物质性质的应用正确的是( ) A. 活泼金属与活泼非金属形成的都是离子键 B. 二氧化硅是制造太阳能电池板的主要材料 C. 二氧化硫通入酸性KMnO4溶液,溶液紫红色褪去,体现了SO2的漂白性 D. 化学反应的实质就是反应物中化学键断裂,生成物中形成新的化学键。 |
|
| 22. 选择题 | 详细信息 |
|
某物质灼烧时,焰色反应为黄色,下列判断正确的是( ) A. 该物质一定是钠的化合物 B. 该物质一定是金属钠 C. 该物质一定含钠元素 D. 该物质一定含钾元素 |
|
| 23. 选择题 | 详细信息 |
|
下列物质与其用途相符合的是( ) ①N2﹣保护气 ②SiO2﹣光导纤维 ③AgI﹣人工降雨 ④碘﹣预防甲状腺肿大 ⑤MgO﹣耐高温材料 ⑥NaClO﹣消毒剂 A. ②③④⑤⑥ B. ①②③④⑤ C. ②③④⑤ D. 全部 |
|
| 24. 选择题 | 详细信息 |
|
某元素原子核外第二层是其他层电子数之和的2倍,则该元素的核电荷数为( ) A. 4 B. 8 C. 12 D. 16 |
|
| 25. 选择题 | 详细信息 |
|
X、Y、Z、W四种主族元素,若X的阳离子与Y的阴离子具有相同的电子层结构;W的阳离子的氧化性强于等电荷数的X阳离子的氧化性;Z的阴离子半径大于等电荷数的Y的阴离子半径,则四种元素的原子序数由大到小的顺序是( ) A. ZYXW B. WXYZ C. XYZW D. ZXYW |
|
| 26. 选择题 | 详细信息 |
|
按C、N、O、F的顺序,下列递变规律错误的是( ) A. 原子半径逐渐减小 B. 元素原子得电子能力逐渐增强 C. 最高正化合价逐渐增大 D. 气态氢化物稳定性逐渐增大 |
|
| 27. 选择题 | 详细信息 |
|
下列说法不正确的是( ) A. 铜呈紫红色.可与氯化铁溶液反应制作印刷电路板 B. 工业上用焦炭在高温下还原二氧化硅可直接得到高纯度的硅 C. 可用丁达尔效应区分胶体和溶液 D. 镁合金大量用于制造火箭、导弹和飞机的部件 |
|
| 28. 选择题 | 详细信息 |
短周期元素X、Y、Z在周期表中的位置如下图所示,则下列说法中错误的是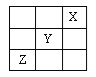 A. X元素的最外层电子数为2 B. Y的气态氢化物的化学式为HY C. Z的最高价氧化物的化学式为ZO2 D. X、Y、Z的单质中X单质最稳定 |
|
| 29. 选择题 | 详细信息 |
|
电子层数相同的三种元素X、Y、Z,已知其最高价氧化物对应水化物的酸性强弱为HXO4>H2YO4>H3ZO4.下列判断错误的是( ) A. 气态氢化物的稳定性:HX>H2Y>ZH3 B. 原子半径:X>Y>Z C. 非金属性:X>Y>Z D. 单质氧化性:X>Y>Z |
|
| 30. 填空题 | 详细信息 |
|
请回答下列问题 (1)写出漂白粉有效成分的化学式_____。水玻璃的主要成分化学式是_____。 (2)写出醋酸在水溶液中的电离方程式_____。 (3)炼铁、制水泥、玻璃,需要共同的原料是________。 (4)写出镁在二氧化碳中燃烧的化学方程式___________________。 (5)写出二氧化硅与焦炭反应的化学方程式___________________。 |
|
| 31. 填空题 | 详细信息 |
|
已知有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,B、C组成的某一种化合物能引起温室效应.常温下,金属D单质投入水中能与水剧烈反应.常温下E单质是常见的气体.请按要求回答下列几个问题: (1)B、D的元素名称分别为:_____、_____; (2)E在周期表中的位置为:_____, (3)C离子的结构示意图为:_____; (4)B、C、D三种元素的原子半径从大到小的顺序为_____(用元素符号表示); (5)B、E的最高价氧化物对应水化物的酸性从强到弱的顺序为:_____(用对应的化学式表示) (6)写出C、D两种元素组成的阴、阳离子个数比为1:2且只含离子键的化合物的电子式:_____; (7)写出E与水反应的离子方程式:_____. |
|
| 32. 实验题 | 详细信息 |
某研究性学习小组设计了如下装置制取和验证SO2的性质。 请回答: (1)写出图中仪器的名称: a___________,b___________。 (2)棉球中NaOH 溶液的作用是______________________。 (3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_____________________。 A.紫色石蕊试液 B.无色酚酞试液 C.澄清石灰水 D.碘水 (4)下列说法正确的是____________。 A.实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下 B.先向装置中加入试剂(药品),再进行气密性检查 C.实验开始后,洗气瓶①和③只溶液均褪色,两者均可证明SO2具有漂白性 D.实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性 (5)洗气瓶④中发生反应的离子方程式为________________________。 |
|
| 33. 填空题 | 详细信息 |
|
将Cu与CuO的混合物20.8g加到50mL 18.4mol•L﹣1浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000mL,测得c(Cu2+)=0.3mol•L﹣1。(以上过程中硫酸始终是浓硫酸,不考虑气体在水中的溶解)试计算: (1)反应过程中放出的气体在标准状况下的体积为________L。 (2)溶解稀释后,氢离子的浓度为_________mol•L﹣1。 |
|
最近更新



