湖南2018年高二上期化学期中考试免费试卷完整版
| 1. 选择题 | 详细信息 |
|
在pH=1的无色溶液中,下列离子能大量共存的是 A. NH4+、Ba2+、NO3-、CO32- B. Fe2+、OH-、SO42-、MnO4- C. K+、Mg2+、NO3-、SO42- D. Na+、Fe3+、Cl-、AlO2- |
|
| 2. 选择题 | 详细信息 |
|
在密闭容器里,A与B反应生成C,其反应速率分别用υA、υB、υC表示,已知2υB =3υA、3υC=2υB, 则此反应可表示为( ) A.A+3B=2C B.2A+3B=2C C.3A+B=2C D.A+B=C |
|
| 3. 选择题 | 详细信息 |
|
相同温度下,等物质的量浓度的下列溶液中,pH最小的是 A. NH4Cl B. NH4HCO3 C. NH4HSO4 D. (NH4)2SO4 |
|
| 4. 选择题 | 详细信息 |
|
下列叙述中,能证明某物质是弱电解质的是( ) A.熔融时不导电 B.水溶液的导电能力很差 C.不是离子化合物,而是极性共价化合物 D.溶液中已电离的离子和未电离的分子共存 |
|
| 5. 选择题 | 详细信息 |
反应X(g)+3Y(g)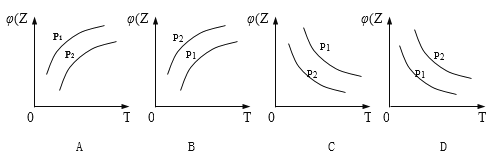 A. A B. B C. C D. D |
|
| 6. 选择题 | 详细信息 |
|
下列说法正确的是 A. 水解反应是吸热反应 B. 升高温度可以抑制盐类的水解 C. 正盐水溶液的pH均为7 D. 酸式盐的pH均小于7 |
|
| 7. 选择题 | 详细信息 |
|
对于0.1mol·L-1Na2SO3溶液,正确的是 A. 升高温度,溶液的pH降低 B. c(Na+)=2c(SO32―)+ c(HSO3―)+ c(H2SO3) C. c(Na+) + c(H+) = 2c(SO32―)+ 2c(HSO3―) + c(OH―) D. 加入少量NaOH固体,c(SO32―)与c(Na+)均增大 |
|
| 8. 选择题 | 详细信息 |
|
强酸与强碱的稀溶液发生中和反应的热效应:H+ (aq)+OH- (aq) =H20(l)△H= -57.3KJ/mol,向1L 0.5mol/L的NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,则恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是 A. △H1> △H2> △H3 B. △H1< △H3< △H3 C. △H2> △H1> △H3 D. △H1> △H3> △H2 |
|
| 9. 选择题 | 详细信息 |
|
A. 由红变橙 B. 由黄变橙 C. 由黄变红 D. 由红变黄 |
|
| 10. 选择题 | 详细信息 |
|
1g氢气燃烧生成液态水,放出142.9kJ热,下列表示该反应的热化学方程式正确的是 A. H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ/mol B. 2H2(g)+O2(g)=2H2O(l)△H=-142.9kJ/mol C. 2H2+O2=2H2O△H=-571.6kJ/mol D. 2H2(g)+O2(g)=2H2O(l)△H=571.6kJ/mol |
|
| 11. | 详细信息 |
|
常温下,某溶液中由水电离的c(H+)=1×10-13 mol/L,该溶液可能是( ) ①二氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液 A. ①④ B. ①② C. ②③ D. ③④ |
|
| 12. 选择题 | 详细信息 |
|
下列说法中可以充分说明反应:P(g)+Q(g)=R(g)+S(g)在恒温下已达平衡状态的是 A. 反应容器内压强不随时间变化 B. P和S的生成速率相等 C. 反应容器内P、Q、R、S四者共存 D. 反应容器内总物质的量不随时间而变化 |
|
| 13. 选择题 | 详细信息 |
|
已知反应A(g)+3B(g)=2C(g)+D(g)在某段时间内以A的浓度变化表示的化学反应速率为1mol·L-1min-1,则此段时间以C的浓度变化表示的化学反应速率为( ) A. 0.5mol·L-1·min-1 B. 1mol·L·min-1 C. 2 mol·L-1·min-1 D. 3mol·L-1·min-1 |
|
| 14. 选择题 | 详细信息 |
|
下列物质中,熵值(S)最大的是 A. 金刚石 B. Cl2(l) C. I2(g) D. Cu(s) |
|
| 15. 选择题 | 详细信息 |
反应2X(g)+Y(g)═2Z(g)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( ) A. T1<T2,P1<P2 B. T1<T2,P1>P2 C. T1>T2,P1>P2 D. T1>T2,P1<P2 |
|
| 16. 填空题 | 详细信息 |
|
把煤作为燃料可通过下列两种途径。 途径I:C(s)+O2(g)= CO2(g)(放热Q1kJ) 途径II先制水煤气: C(s)+ H2O(g)= CO(g)+H2(g)(吸热Q2 kJ) 再燃烧X煤气:2CO(g)+O2(g)==2CO2(g) 2H2(g)+O2(g)=2H2O(g)(共放热Q3kJ) 试回答: (1)途径I放出的热量-___________(填“>”、“=”、“<”)途径II放出的热量。 (2)Q1、Q2、Q3的数学关系式是_________ 。 |
|
| 17. 填空题 | 详细信息 |
|
一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写) ①当其物质的量浓度相同时,c(H+)由大到小的顺序是____, ②同体积同物质的量浓度的三种酸,中和NaOH能力的顺序是____________ ③当其c(H+)相同时,物质的量浓度由大到小的顺序为____, ④当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序为 ___。 |
|
| 18. 填空题 | 详细信息 |
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5 (g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。 根据上图回答下列问题: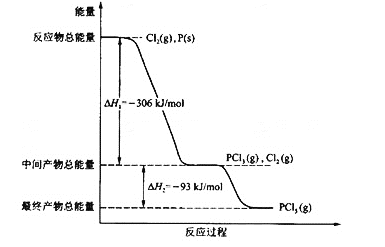 (l) PCl5分解成PC13和Cl2的热化学方程式是___________上述分解反应是一个可逆反应。温度T1时,在密闭容器中加人0.80 mol PCl5,反应达平衡时PCls还剩0.60 mol,其分解率a1等于____;若反应温度由T1升高到T2,平衡时PCls的分解率为a2,a2 ___a1(填“大于”、“小于”或“等于”); (2)工业上制备PCl5通常分两步进行,先将P和CL2反应生成中间产物PC13,然后降温,再和Cl2反应生成PCl3原因是________. |
|
| 19. 填空题 | 详细信息 |
常温下,将某一元酸HX和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表: 请回答: (1)不考虑其他组的实验结果,单从甲组情况分析,若a ___7(填“>""<”或“=”),则HX为强酸;若a_________7(填“>“‘<”或“=”),则HX为弱酸. (2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是____. A.前者大 B.后者大 C.二者相等 D.无法判断 (3)从丙组实验结果分析,HX是___ 酸(填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是________. (4)丁组实验所得混合溶液中由水电离出的c(OH-)=_________mol/L. |
|
| 20. 填空题 | 详细信息 |
|
在一定条件下,可逆反应:mA+nB (1)A、C是气体,增加B的量,平衡不移动,则B为_____态。 (2)加热后,可使C的质量增加,则正反应是__反应(放热或吸热)。 |
|
最近更新



