2019-2020年度高一后半期期中考试化学免费试卷完整版(广东省珠海市珠海一中 )
| 1. 选择题 | 详细信息 |
|
下列关于物质分类及胶体性质描述正确的是 ( ) A.熟石灰、烧碱、纯碱都是碱 B.明矾、漂白粉、硫酸铜均为纯净物 C.“血液透析”和“静电除尘”分别利用了胶体的不同性质 D.纳米材料粒子直径一般从几纳米到几十纳米,因此纳米材料属于胶体 |
|
| 2. 选择题 | 详细信息 |
|
NA 为阿伏加德罗常数的值。下列说法正确的是 ( ) A.18g B.标准状况下,2.24L SO3 中含有的氧原子数目为 0.3 NA C.物质的量浓度为 0.1mol•L﹣1 的 MgCl2 溶液中,含有 Cl﹣个数为 0.2 NA D.一定条件下,2.3g 的金属钠完全与氧气反应时生成 3.6g 产物时失去的电子数为 0.1NA |
|
| 3. 选择题 | 详细信息 |
|
下列各组离子一定能大量存在的是 ( ) A.在中性溶液中: B.在酸性溶液中: C.滴入酚酞显红色的溶液: D.加入铝粉可以产生 H2 的溶液中: |
|
| 4. 选择题 | 详细信息 |
|
下列表示对应化学反应的离子方程式正确的是 ( ) A.将 CO2 通入 CaCl2 溶液:CO2+H2O+Ca2+=CaCO3↓+2H+ B.往氢氧化钠溶液中通入过量 SO2:OH- + SO2 = C.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O D.向 Ba(OH)2 溶液中滴加NaHSO4 溶液至中性:Ba2++OH-+H++ |
|
| 5. 选择题 | 详细信息 |
|
铜与稀硫酸不发生反应,但如果在铜与稀硫酸的混合溶液中加入某种盐,就能发生反应, 且有气体、有沉淀产生,则该盐是 ( ) A.Ba(NO3)2 B.KCl C.Na2SO4 D.FeCl3 |
|
| 6. 选择题 | 详细信息 |
|
在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体 ICl,ICl有很强的氧化性,ICl 跟 Zn、H2O 反应的化学方程式如下:2IC1+2Zn=ZnCl2+ZnI2, IC1+H2O=HC1+HIO,下列关于 ICl 性质的叙述正确的是( ) A.ZnCl2 是氧化产物,又是还原产物 B.ZnI2 既是氧化产物,又是还原产物 C.反应 6.5gZn,转移电子 0.1mol D.ICl 跟 H2O 的反应,ICl 是氧化剂,H2O 是还原剂 |
|
| 7. 选择题 | 详细信息 |
|
下列有关化学用语使用正确的是 ( ) A.原子核内有 10 个中子的氧原子: C.硫原子的原子结构示意图: 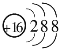 D.NH4Cl 的电子式: D.NH4Cl 的电子式: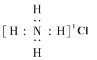 |
|
| 8. 选择题 | 详细信息 |
|
下列物质的制取原理错误的是 ( ) A.金属钠的制取:2NaCl(熔融) B.金属镁的制取:MgO+CO C.金属铬的制取:Cr2O3+2Al D.金属汞的制取:2HgO |
|
| 9. 选择题 | 详细信息 |
|
硅及其化合物在材料领域中应用广泛。下列叙述正确的是( ) A.晶体硅可做光导纤维 B.SiO2 可与水反应制备硅胶 C.玻璃、水泥、陶瓷都是硅酸盐产品 D.SiO2 与 NaOH 和 HF 均可反应,属于两性氧化物 |
|
| 10. 选择题 | 详细信息 |
下列关于硫及其化合物的说法正确的是( )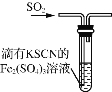 A.浓硫酸具有脱水性,可用于干燥氨气 B.加氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有 C.二氧化硫能使溴水、酸性高锰酸钾溶液褪色,因其有漂白性 D.如图装置中血红色褪去,可以验证 SO2 的还原性 |
|
| 11. 选择题 | 详细信息 |
|
下列每组物质发生转化所克服的粒子间的相互作用属于同种类型的是( ) A. 碘和干冰升华 B. 氯化钠的熔化与冰的融化 C. 氯化氢和酒精溶于水 D. CO2气体通入澄清石灰水 |
|
| 12. 选择题 | 详细信息 | ||||||||||||||||||||
下列除杂试剂的选择或除杂操作不正确的是( )
|
|||||||||||||||||||||
| 13. 选择题 | 详细信息 |
|
在短周期主族元素X、Y、Z中,X与Y两元素的原子核外的电子层数相同,X的原子半径大于Y的原子半径,X的阳离子与Z的阳离子具有相同的电子层结构,Z的简单离子半径大于X的简单离子半径。则关于X、Y、Z的叙述正确的是( ) A.三种元素的原子序数最大的是Z B.Z一定是非金属元素 C.三种元素不一定是同周期元素 D.三种元素可能都是金属元素 |
|
| 14. 选择题 | 详细信息 |
“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”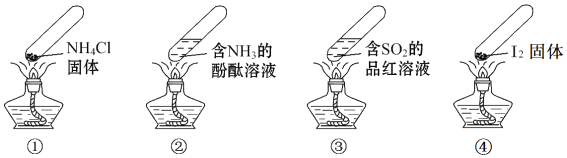 A. 加热时, B. 加热时, C. 加热时, D. 加热又冷却的过程中, |
|
| 15. 选择题 | 详细信息 |
|
向 BaCl2 溶液中通入 SO2 气体,溶液仍然澄清;若将BaCl2 溶液分盛在两支试管中,一只试管加稀HNO3,另一只加NaOH 溶液,然后再通入SO2 气体,结果两支试管都有白色沉淀产生。由此得出的下列结论中不合理的是( ) A.SO2 是酸性氧化物、SO2 具有还原性 B.两支试管中的白色沉淀不是同种物质 C.BaCl2 既能跟强酸、又能跟强碱反应,具有两性 D.加入氢氧化钠溶液,SO2 水溶液中 |
|
| 16. 选择题 | 详细信息 |
|
一种无色气体 100mL,由 NH3、NO、CO2 所组成,将此无色气体通过浓硫酸的洗气瓶后, 发现气体减少了 30mL。剩余气体继续通过 Na2O2 固体后,发现气体变成红棕色,再将该气体通入盛满水倒立于水槽中的试管内,发现试管内水位上升,最后试管内充满液体。则原混合气体中 NH3、NO、CO2 气体的体积比为( ) A.15∶14∶21 B.5∶8∶12 C.10∶14∶21 D.30∶28∶23 |
|
| 17. 选择题 | 详细信息 | |||||||||||||||||||||||||
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是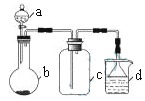
|
||||||||||||||||||||||||||
| 18. 选择题 | 详细信息 |
已知A是一种常见的非金属单质,B是氧化物,E是A的氢化物,D是A的最高价氧化物对应的水化物,上述物质间转化关系如图所示。下列说法错误的是 ( )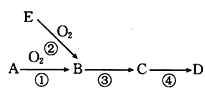 A. 若E、D的水溶液均呈酸性,则A为硫 B. 若D是一种难溶于水的物质,则A为硅 C. 若E、D的水溶液均呈酸性,则B能与水反应 D. 若D是一种难溶于水的物质,则B能与水反应 |
|
| 19. 选择题 | 详细信息 |
|
某溶液中含如下离子组中的几种 Ⅰ.用铂丝醮取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰 Ⅱ.另取原溶液加入足量盐酸有无色气体生成,此时溶液颜色加深,但无沉淀生成 Ⅲ.取Ⅱ反应后溶液分别置于两支试管中,第一支试管中加入 BaCl2 溶液有白色沉淀生成, 再滴加 KSCN 溶液,上层清液变红,第二支试管加入 CCl4,充分振荡静置后溶液分层,下层为无色。 下列说法正确的是( ) A.原溶液中肯定不含 B.原溶液中肯定含有 C.步骤Ⅱ中无色气体是 NO 气体,无 CO2 气体产生 D.为确定是否含有 Cl-可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 |
|
| 20. 选择题 | 详细信息 |
|
用 FeCl3 溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉,对加入铁粉充分反应后的溶液分析合理的是( ) A.若无固体剩余,则溶液中一定有 Fe3+ B.若有固体剩余,则溶液中一定有 Fe2+ C.若溶液中有Cu2+,则一定没有固体析出 D.若溶液中有 Fe2+,则一定有 Cu 析出 |
|
| 21. 选择题 | 详细信息 |
下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( )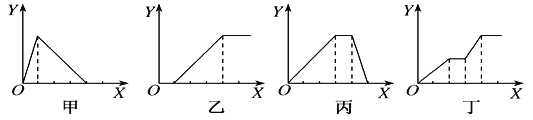 A. 甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡 B. 乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡 C. 丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量 D. 丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量 |
|
| 22. 综合题 | 详细信息 |
已知海水中的溴含量约为 65 mg·L-1,从海水中提取溴的工业流程如下: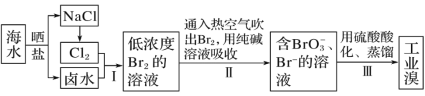 (1)步骤Ⅱ通入热空气吹出 Br2,利用了溴的_______(填序号)。 A.氧化性 B.还原性 C.挥发性 D.腐蚀性 (2)步骤Ⅱ中涉及的离子反应如下,请在横线上填入正确的化学计量数: ___Br2 +___ (3)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后 进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为________________________。 (4)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有________________(填字母)。 A.乙醇 B.四氯化碳 C.醋酸 D.苯 |
|
| 23. 综合题 | 详细信息 |
|
A、B、C、D、E、F、G 是短周期元素,周期表中 B 与 C 相邻,C 与 E 同主族; A 中 L 层是 K 层的 2 倍,B 的电子数比 C 的电子数少 1 个;F 元素的原子在周期表中半径最小;常见化合物 D2C2 与水反应生成 C 的气体单质,且完全反应后的溶液能使酚酞溶液变红。G 是第三周期原子半径最小的主族元素。 (1)A 在元素周期表中的位置_________________ 。 (2) D2C2 的电子式为________ , 属于________________化合物(填“离子”或“共价”)。 (3)C 与 F 元素可形成 18 电子分子的电子式为 。 (4)A、B、C 的氢化物稳定性顺序为____________________(用分子式表示); G 的阴离子的还原性比 E 的阴离子的还原性 ___________________________(填“强”或“弱”)。 (5)F2C 和 F2E 中,沸点较高的是________(填化学式),其主要原因是 _____________。 (6)锡(Sn)与 A 同主族,常温下能和浓硫酸反应,生成 Sn(SO4)2 和刺激性气味气体, 反应的化学方程式为 __________________________________。 |
|
| 24. 综合题 | 详细信息 |
氮氧化合物和二氧化硫是引起雾霾的重要物质,工业用多种方法来治理。某种综合处理含 NH4+废水和工业废气(主要含 NO、CO、CO2、SO2、N2)的流程如图: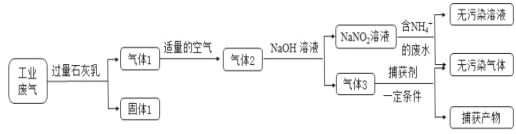 已知:NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO3+NaNO2+H2O (1)固体 1 的主要成分有 Ca(OH)2、___________________、__________________(填化学式)。 (2)若实验室需要配制100mL 3.00mol·L-1NaOH溶液进行模拟测试,需用托盘天平称取 NaOH固体质量为______g。 (3)用 NaNO2 溶液处理含NH4+废水反应的离子方程式为_______________________。 (4)捕获剂从气体 3 中捕获的气体主要是__________________ (填化学式)。 (5)流程中生成的 NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O;I2 可以使淀粉变蓝。根据上述反应, 选择生活中常见的物质和有关试剂进行实验,以鉴别 NaNO2 和 NaCl。需选用的物质是_____________________(填序号)。 ①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋 A.①③⑤ B.①②④ C.①②⑤ D.①②③⑤ |
|
| 25. 综合题 | 详细信息 |
氯气与碱溶液反应,在低温、稀碱溶液中主要产物是 ClO3-和 Cl-,在 75℃以上、浓碱溶液中主要产物是ClO-和 Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。(夹持装置已省略) a 为浓盐酸,b 为MnO2,c 为饱和食盐水, d 为 30%KOH 溶液,e 为 NaOH 溶液 回答下列问题: (1)检查装置气密性后,添加药品,待装置 III 水温升至 75℃开始反应。 ①装置 II 的作用为_____________________________________。 ②若取消装置 II,对本实验的影响是___________________。 ③从装置 III 的试管中分离得到 KClO3 粗产品,其中混有的杂质是 KClO 和_____________(填化学式)。 (2)为测定产品 KClO3 的纯度,进行如下实验: 步骤 1:取 3.00g 样品溶于水配成 250mL 溶液。 步骤 2:取 25.00mL 溶液于锥形瓶中,滴加足量H2O2 溶液充分振荡以除尽ClO-。然后煮沸溶液 1~2 分钟,冷却。 步骤 3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3- +6I- +6H+= Cl-+3I2+3H2O) 步骤 4:加入指示剂,用 0.600mol/LNa2S2O3 标准溶液滴定至终点,消耗标准溶液 20.00mL。(2S2O32-+I2=S4O62-+2I-) 步骤 2 中除去 ClO-的离子方程式是_________________。 ②样品中 KClO3 的貭量分数为_____。(保留三位有效数字,KClO3 式量:122.5) |
|
最近更新



