河南高一化学2018年前半期期末考试同步练习
| 1. 选择题 | 详细信息 |
|
下列各组混合物只用分液漏斗无法分离的是( ) A. 植物油和水 B. NaOH溶液和四氯化碳 C. 四氯化碳和稀硫酸 D. 酒精和水 |
|
| 2. 选择题 | 详细信息 |
|
下列说法中正确的是( ) A. 同温同压下,具有相同数目分子的气体必具有相同的体积 B. 等质量的O2和H2的物质的量之比为16∶1 C. 不同的气体若体积不等,则它们所含的分子数一定不等 D. 同温同体积下,两种气体的物质的量之比等于密度之比 |
|
| 3. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A. 利用丁达尔效应可以区分溶液和胶体 B. 所有金属元素都可以用焰色反应来鉴别 C. 水泥、玻璃、光导纤维的主要成分都属于硅酸盐 D. pH值小于7的雨水称为酸雨 |
|
| 4. 选择题 | 详细信息 |
|
下 列离子方程式书写正确的是( ) A. 氯气通入水中:Cl2+H2O = 2H++Cl-+ClO- B. 铁和稀硫酸反应:2Fe+6H+ = 2 Fe3++3H2↑ C. 碳酸钙与醋酸反应:CaCO3+2H+ = Ca2++CO2↑+H2O D. 氢氧化铝和氢氧化钠溶液反应:Al(OH)3+OH- = AlO2-+2H2O |
|
| 5. 选择题 | 详细信息 |
|
将等体积的SO2 和Cl2充分混合后,通入加有品红的氯化钡溶液,观察到的现象是( ) A. 褪色并生成沉淀 B. 溶液缓慢褪色 C. 生成白色沉淀 D. 无现象 |
|
| 6. 选择题 | 详细信息 |
|
下列各项操作中不发生先沉淀后溶解现象的是 ①向饱和碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴滴加入过量H2SO4 ③向Ba(NO3)2溶液中通入过量SO2 ④向石灰水中通入过量CO2 ⑤向硅酸钠溶液中逐滴加入过量的盐酸 A. ①②③ B. ①②⑤ C. ①②③⑤ D. ①③⑤ |
|
| 7. 选择题 | 详细信息 |
|
下列各组物质在溶液中反应时,以任意比混合均能用同一离子方程式表示的是( ) A. AlCl3溶液和NaOH溶液 B. Ba(OH)2溶液与稀硫酸 C. Na2CO3溶液和稀盐酸 D. NaAlO2溶液和稀盐酸 |
|
| 8. 选择题 | 详细信息 |
|
某溶液中加入铝粉有氢气产生,该溶液中一定不能大量共存的离子组是( ) A. Na+ NO3- CO32- Cl- B. ClO- Ba2+ Na+ AlO2- C. K+ Fe2+ NO3- Cl- D. Cl- Na+ K+ SO42- |
|
| 9. 选择题 | 详细信息 |
|
下列各化合物不能直接由单质间化合制取的是( ) A. FeCl3 B. CuCl2 C. AlCl3 D. FeCl2 |
|
| 10. 选择题 | 详细信息 |
|
由镁、铝、铜三种金属粉末组成的混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,滤液中存在的离子有( ) A. Mg2+ B. Cu2+ C. Al3+ D. AlO2- |
|
| 11. 选择题 | 详细信息 |
|
下列的说法,正确的是( ) A. 1 mol FeI2 与足量的氯气反应时转移的电子数为3 NA B. 12 mol/L的浓硫酸50 ml 与足量的Cu加热反应,得到SO2为0.3 mol C. 配制一定物质的量浓度溶液时,溶液的体积与容量瓶的量程一致 D. 1 mol NaHSO4固体中含离子总数为4NA |
|
| 12. 选择题 | 详细信息 |
|
己知在碱性溶液中可发生如下反应: 2R(OH)3+ 3C1O-+ 4OH-= 2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是( ) A. +3 B. +4 C. +5 D. +6 |
|
| 13. 选择题 | 详细信息 |
|
已知还原性由强到弱的顺序为SO3 2- >I ->Br -,向NaBr、NaI、Na2 SO3 的混合溶液中通入一定量的氯气后,将溶液蒸干并充分灼烧,得到的剩余固体物质的组成可能是( ) A. NaCl B. NaCl、 NaBr、 Na2 SO4 C. NaCl、Na2 SO4、I2 D. NaCl、Na2 SO4 、 NaI |
|
| 14. 选择题 | 详细信息 |
|
现有两份等体积等浓度的NaOH溶液,分别与体积相等的AlCl3、MgCl2溶液混合,充分反应后Al3+、Mg2+均恰好形成沉淀,则原MgCl2、AlCl3两溶液的物质的量浓度之比( ) A. 2:3 B. 1:2 C. 1:1 D. 3:2 |
|
| 15. 选择题 | 详细信息 |
|
氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是( ) A. HI和HClO B. HCl和HIO C. HClO3和HIO D. HClO和HIO |
|
| 16. 选择题 | 详细信息 |
|
CO2 和氢氧化钠溶液反应,所得产物中 Na2CO3 和 NaHCO3 物质的量之比为 3 :5 ,则参加反应的 CO2 和NaOH 的物质的量之比为 A. 3 :5 B. 1 : 2 C. 8 : 11 D. 18 : 8 |
|
| 17. 选择题 | 详细信息 |
|
将1.92 g Cu和一定量的浓HNO3反应,随Cu不断减少,反应生成气体的颜色逐渐变浅,当Cu 完全消耗时,共收集到气体1.12 L(标况),反应中消耗HNO3物质的量为( ) A. 无法计算 B. 0.11 mol C. 0 .65 mol D. 0.8 mol |
|
| 18. 选择题 | 详细信息 |
由二氧化硅制高纯硅的流程如下,下列判断中错误的是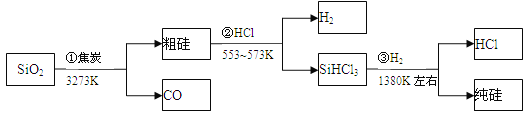 A. ①②③均属于氧化还原反应 B. H2和HCl均可循环利用 C. SiO2是一种坚硬难熔的固体 D. SiHCl3摩尔质量为135.5g |
|
| 19. 综合题 | 详细信息 |
现有常见金属单质A、B、C和常见气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。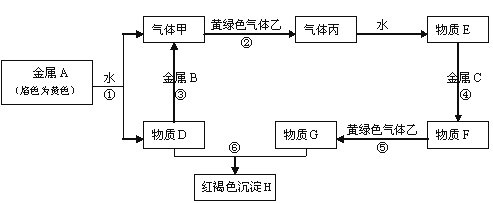 请根据以上信息回答 下列问题: (1)写出下列物质的化学式: A____B________ F_____ 丙______ (2)写出下列反应离子方程式: 反应③__________________________________________ 反应⑤_________________________________________ 反应⑥_________________________________________ |
|
| 20. 填空题 | 详细信息 |
|
有下列物质: ①Na2CO3•10H2O 晶体 ②铜 ③硫酸溶液 ④CO2 ⑤NaHSO4 固体 ⑥Ba(OH)2 固体 ⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3 固体。 (1)上述物质属于电解质的有__________(填编号)。 (2)上述物质中有两种物质之间可发生离子反应: H++OH-=H2O,写出该离子反应对应的化学方程式___________。 (3)17.1g⑩溶于水配成 250mL 溶液, SO42-的物质的量浓度为_______。 (4)写出固体⑤溶于水中的电离方程式___________。 |
|
| 21. 实验题 | 详细信息 |
Ⅰ.如图所示为常见玻璃仪器的部分结构: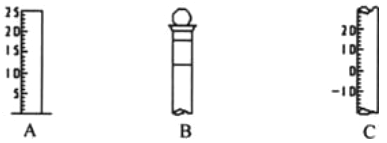 (1)请写出所列仪器的名称: A______,B_______,C_______; (2)仪器 B 使用前必须__________________。 (3)仪器 B 上标记有________(填序号);①质量 ②温度 ③刻度线 ④浓度 ⑤容积 II.已知某“84 消毒液”瓶体部分标签如图所示,该“84 消毒液”通常稀释 100 倍(体积之比)后使用。请回答下列问题:  (1)该“84 消毒液”的物质的量浓度约为___mol·L-1。保留两位有效数字) (2)某同学取100 mL该液”,稀释后用于消毒,稀释后的溶液中 c (Na+)=_____ mol·L-1。 (3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 250 mL含 NaClO 质量分数为 25%的消毒液。下列说法不正确的是________(填序号)。 a.如图所示的仪器中,有三种是不需要的,还需要其它玻璃仪器 b.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 c.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低 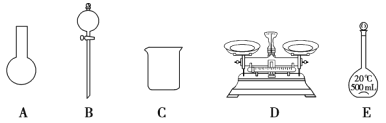 (4) “84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 98%(密度为1.84g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1 的稀硫酸用于增强“84 消毒液”的消毒能力。需用浓硫酸的体积为___mL。 |
|
| 22. 综合题 | 详细信息 | ||||||||||||||||
右图是某儿童微量元素体检报告单的部分数据:
|
|||||||||||||||||
最近更新



