四川省邻水实验学校2021届高三下册3月开学考试理综化学免费试卷带答案和解析
| 1. 选择题 | 详细信息 |
|
化学与生产生活密切相关,下列说法正确的是( ) A.SiO2 具有导电性,可用于制作光导纤维和光电池 B.棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O C.煤的干馏与石油的催化重整均属于化学变化 D.金属材料都是导体,非金属材料都是绝缘体 |
|
| 2. 选择题 | 详细信息 |
|
NA代表阿伏加德罗常数的值。下列说法正确的是 A.5.6 g 铁粉与足量硝酸加热充分反应后,产生H2的分子数为0.1NA B.标准状况下22.4 LO2与足量H2反应生成H2O,转移的电子数为4NA C.1 L0.1 mol/L硫酸钠溶液中含有的氧原子数为0.4NA D.1 LpH=13的Ba(OH)2溶液中Ba2+数目为0.1NA |
|
| 3. 选择题 | 详细信息 |
金丝桃苷是从中药材中提取的一种具有抗病毒作用的黄酮类化合物,结构式如图:下列关于的叙述,错误的是( )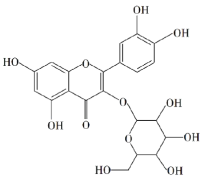 A.1 mol该物质可与8 mol H2反应 B.该分子中不含有手性碳原子 C.该分子可发生加成、取代、氧化和消去等反应 D.该分子易溶于甲醇、乙醇等极性溶剂 |
|
| 4. 选择题 | 详细信息 |
|
下列指定反应的离子方程式正确的是( ) A.Ag2SO3 溶于氨水:Ag+ + 2NH3·H2O =Ag(NH3)+ + 2H2O B.向碘化钾溶液中加入少量的双氧水:3H2O2+I- =IO C.硅酸钠溶液和盐酸反应:Na2SiO3 + 2H+ = H2SiO3↓+ 2Na+ D.氢氧化钠溶液与过量的碳酸氢钙溶液反应:OH- + Ca2+ + HCO |
|
| 5. 选择题 | 详细信息 |
|
短周期主族元素W、X、Y、Z的原子序数依次增大,W的核外电子数等于其主族序数,X的单质在空气中含量最多,Y的最高价氧化物的水化物是两性化合物,Z的最高正价与最低负价代数和为4.下列说法错误的是 A.W与X形成的最简单化合物极易溶于水 B.Y和Z可形成化合物Y2Z3 C.最外层电子数Z>X>Y>W D.Y和Z的简单离子的电子层结构相同 |
|
| 6. 选择题 | 详细信息 | |||||||||||||||
由下列实验操作及现象所得结论错误的是
A.A B.B C.C D.D |
||||||||||||||||
| 7. 选择题 | 详细信息 |
现由 H2、O2 和熔融盐 Na2CO3 组成的燃料电池,采用电解法制备 N2O5,装置如图所示。 下列说法错误的是( ) A.图示左装置是原电池,右装置是电解池 B.石墨电极 I 是负极,Y是CO2 C.与石墨电极 II 相连接的铂电极发生:N2O4-2e-+ 2NO D.右装置工作时,H+可以从左池经过隔膜进入右池 |
|
| 8. 实验题 | 详细信息 |
某化学兴趣小组制取氯水、氯酸钾和次氯酸钠并进行有关探究实验。 (1)盛放浓盐酸的仪器名称是_______,装置 a 的实验目的是_______。 (2)b 中所发生的离子方程式是_______,c 中采用冰水浴冷却的目的是_______ 。 (3)d 的作用是_______可选用的试剂 _______ (填标号) A.Na2SO3 B.NaCl C.Ca(OH)2 D.H2SO4 (4)制取实验结束后,取出b中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有_______。 (5)假如a中盛放的是蒸馏水,则可以制取氯水。若对调a和b装置的位置,b中氯酸钾的产率是否降低_______ (填“是”或“否”)。 |
|
| 9. | 详细信息 | ||||||||||||||||||
碳酸锶(SrCO3)是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(含 80~90%的 SrCO3,少量 MgCO3、CaCO3、BaCO3 等)制备高纯碳酸锶的工艺流程如图: Sr(OH)2在水中的溶解度见表
(1)菱锶矿、焦炭混合粉碎的目的是_______。 |
|||||||||||||||||||
| 10. 综合题 | 详细信息 |
|
探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下: Ⅰ. Ⅱ. Ⅲ. 回答下列问题: (1) (2)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为__________mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________。 (3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。 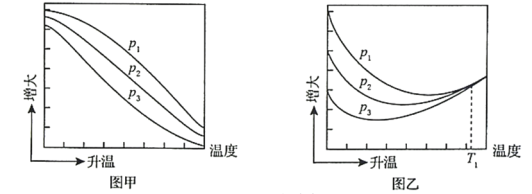 已知:CO2的平衡转化率= 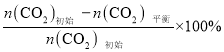 CH3OH的平衡产率= 其中纵坐标表示CO2平衡转化率的是图___________(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________;图乙中T1温度时,三条曲线几乎交于一点的原因是___________。 (4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_________(填标号)。 A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压 |
|
| 11. | 详细信息 |
|
[化学——选修3:物质结构与性质] 氧族元素单质及其化合物在生活、生产中有广泛应用。回答下列问题: (1)基态硒原子价层电子排布式为____________;基态氧原子核外电子占据____________个轨道。 (2)硒的含氧酸有H2SeO3,H2SeO4。酸性:H2SeO3____________H2SeO4(填“>”“<”或“=”)。SeO32的空间构型是_____________________。 (3)配体中配位原子提供孤电子对能力与元素电负性有关,SCN的结构式可以表示为[S=C=N]或[S-C≡N],SCN与Fe3、Au和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN中提供孤电子对的原子可能是____________。 (4)灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用力很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图、晶胞俯视图如图所示。  ①螺旋链状中硒原子采用____________杂化,1 mol晶胞含____________个硒原子(NA是阿伏加德罗常数的值)。 ②螺旋链内硒原子之间存在的作用力类型是____________(填字母)。 A.分子间作用力 B.π键 C.σ键 D.非极性键 E.极性键 (5)FeS2晶胞如图所示。连接面心上S22-构成正八面体(Fe2+位于体心)。已知正八面体的边长为x pm,NA是阿伏加德罗常数的值。该晶胞参数(a)为____________pm,晶体密度为____________g•cm3(用含x和NA的代数式表示)。 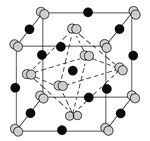 |
|
| 12. 综合题 | 详细信息 |
以苯和丙酮为原料合成化妆品中间体M路线如下: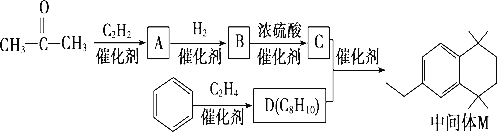 已知: ①R—CH=CH—R′+ ②R—C≡CH+ 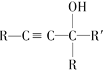 (R、R′代表烃基或氢原子) (R、R′代表烃基或氢原子)(1) A的结构简式为____________,A中含有的官能团名称是__________。 (2) 生成A和C的反应类型依次是____、_____。中间体M的分子式为_______。 (3) 写出流程中由苯生成D的化学方程式:___________________________。 (4) C为二烯烃(C8H14),写出符合下列条件的C的一种同分异构体的结构简式______________。 ① 含有六个碳形成的碳环, ② 核磁共振氢谱图中显示有四组峰,且峰面积之比为3∶2∶1∶1, (5) 设计以乙醛(CH3CHO)、C2H2为原料制备 |
|
最近更新



