2018-2019年高二上期期中考试化学题带答案和解析(福建省三明市第一中学)
| 1. 选择题 | 详细信息 |
|
下列关于能量变化的说法正确的是 A. “冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高 B. 化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种 C. 已知C(石墨,s)=C(金刚石,s)ΔH>0,则金刚石比石墨稳定 D. 化学反应遵循质量守恒的同时,也遵循能量守恒 |
|
| 2. 选择题 | 详细信息 |
|
下列化学反应属于吸热反应的是 A. 木炭燃烧 B. 铝热反应 C. 氯化铵与消石灰反应 D. 氢氧化钠与硝酸反应 |
|
| 3. 选择题 | 详细信息 |
|
设C(s)+CO2(g) A. 同时增大 B. 同时减小 C. v 1增大,v 2减小 D. v 1减小,v 2增大 |
|
| 4. 选择题 | 详细信息 |
|
反应2A(g) A. 升温 B. 降温 C. 加压 D. 减压 |
|
| 5. 选择题 | 详细信息 |
|
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是 A. CuCl2 [CuSO4] B. NaOH [NaOH] C. NaCl [HCl] D. CuSO4 [Cu(OH)2] |
|
| 6. 选择题 | 详细信息 |
|
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是 A. 脱氧过程是吸热反应,可降低温度,延长糕点保质期 B. 脱氧过程中铁作原电池正极,电极反应为:Fe-3e→Fe3+ C. 脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e→4OH- D. 含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
|
| 7. 选择题 | 详细信息 |
|
以下说法中正确的是 A. 冰在室温下自动熔化成水,是熵增的重要结果 B. 高锰酸钾加热分解是一个熵减小的过程 C. △H<0的反应均是自发反应 D. △S为负值的反应均不能自发进行 |
|
| 8. 选择题 | 详细信息 |
|
中和热的数值是57.3kJ/mol。下列酸、碱溶液混合产生的热量等于57.3kJ的是( ) A. 1mol/L的稀HCl溶液与1mol/L的稀NaOH溶液 B. 1mol/L的稀H2SO4溶液与1mol/L的稀NaOH溶液 C. 1L 1mol/L的稀HCl溶液与1L 1mol/L的稀NaOH溶液 D. 1L 1mol/L的稀H2SO4溶液与1L 1mol/L的稀Ba(OH)2溶液 |
|
| 9. 选择题 | 详细信息 |
|
下列关于平衡常数的说法正确的是 A. 在平衡常数表达式中,反应物浓度用起始浓度表示,生成物浓度用平衡浓度表示 B. 可以用化学平衡常数来定量描述化学反应的限度 C. 可逆反应中,反应物的转化率增大,一定导致化学平衡常数增大 D. 平衡常数的大小与温度、浓度、压强、催化剂有关 |
|
| 10. 选择题 | 详细信息 |
|
下列金属防护的方法中,应用了牺牲阳极的阴极保护法的是 A. 钢铁船身嵌入锌 B. 钢闸门与直流电源负极相连 C. 健身器材刷油漆 D. 车圈、车铃钢上镀铬 |
|
| 11. 选择题 | 详细信息 |
|
可逆反应A(g)+3B(g) A.VA=0.15mol•(L•min)﹣1 B.VB=0.6 mol•(L•min)﹣1 C.VC=0.4 mol•(L•min)﹣1 D.VD=0.01 mol•(L•s)﹣1 |
|
| 12. 选择题 | 详细信息 |
|
将1molN2气体和3molH2气体在2L的恒容容器中,并在一定条件下发生如下反应:N2(g)+3H2(g) A. 用N2表示的反应速率为0.15mol·L-1·s-1 B. 2s时H2的转化率为40% C. 2s时N2与H2的转化率相等 D. 2s时H2的浓度为0.6mol·L-1 |
|
| 13. 选择题 | 详细信息 |
|
在恒温恒容的密闭容器中,发生可逆反应2NO(g) + O2(g) A. 正反应生成NO2的速率和逆反应生成NO的速率相等 B. 反应容器中压强不随时间的延长而变化 C. 混合气体颜色深浅保持不变 D. 混合气体的密度不随时间延长而变化 |
|
| 14. 选择题 | 详细信息 |
|
反应C(s)+H2O(g) ①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2 使体系压强增大 ④保持压强不变,充入N2使容器体积变大 A. ①④ B. ②③ C. ①③ D. ②④ |
|
| 15. 选择题 | 详细信息 | ||||||||||||||||||||
下列对化学反应预测正确的是()
|
|||||||||||||||||||||
| 16. 选择题 | 详细信息 |
如图是关于可逆反应(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是 A. 升高温度 B. 降低压强 C. 增大反应物浓度,同时使用正催化剂 D. 增大反应物浓度,同时减小生成物浓度 |
|
| 17. 选择题 | 详细信息 |
|
铅蓄电池放电时的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列判断错误的是 A. 放电时Pb为负极 B. 充电时阳极的电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- C. 放电完全后铅蓄电池可进行充电,此时铅蓄电池的负极连接外电源的正极 D. 用铅蓄电池电解CuCl2溶液,若制得2.24L Cl2(标准状况),这时电池内至少转移0.2 mol电子 |
|
| 18. 选择题 | 详细信息 |
|
下列说法中有明显错误的是( ) A. 对有气体参加的化学反应,增大压强(体系体积减小),可使单位体积内活化分子数增加,因而反应速率增大 B. 升高温度,一般可使活化分子的百分数增大,因而反应速率增大 C. 活化分子之间发生的碰撞一定为有效碰撞 D. 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率 |
|
| 19. 选择题 | 详细信息 |
反应2SO2(g) + O2(g) 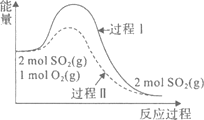 A. 2SO2(g) +O2(g) B. 过程II可能使用了催化剂,使用催化剂不可以提高SO2的平衡转化率 C. 反应物断键吸收能量之和小于生成物成键释放能量之和 D. 将2molS02(g)和1 mol 02(g)置于一密闭容器中充分反应后放出的热量小于a kJ |
|
| 20. 选择题 | 详细信息 |
下列关于金属腐蚀与防护的说法不正确的是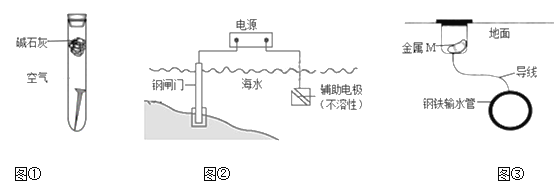 A. 图①,放置于干燥空气中的铁钉不易生锈 B. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀 C. 图②,若断开电源,钢闸门将发生吸氧腐蚀 D. 图③,若金属M比Fe活泼,可防止输水管腐蚀 |
|
| 21. 选择题 | 详细信息 |
|
恒温、恒压下,1 mol A和1 mol B在一个容积可变的密闭容器中发生如下反应:A(g)+2B(g) A. 物质A、B的转化率之比一定是1:2 B. 起始时刻和达到平衡后容器中的压强比为1:1 C. 若起始放入3 mol A和3 mol B,则达到平衡时生成3a mol C D. 当v(正)(A)=v(逆)(B)时,可断定反应达到平衡 |
|
| 22. 选择题 | 详细信息 |
某密闭容器中发生如下反应:2X(g)+Y(g)  A. t6时刻后反应物的转化率最低 B. t5时增大了压强 C. t4时该反应的平衡常数小于t6时反应的平衡常数 D. t3时降低了温度 |
|
| 23. 选择题 | 详细信息 |
|
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 A. CO与HbO2反应的平衡常数K= B. 当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损 C. 人体吸入的CO越多,与血红蛋白结合的O2越少 D. 把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动 |
|
| 24. 选择题 | 详细信息 | |||||||||||||||
下列选项中的原因或结论与现象不对应的是
|
||||||||||||||||
| 25. 填空题 | 详细信息 | ||||||||||||||||||||
在一固定容积的密闭容器中进行着如下反应: CO2(g) + H2(g)
|
|||||||||||||||||||||
| 26. 填空题 | 详细信息 |
|
已知反应:2SO2(g)+O2(g) (1)某温度下,在一固定体积为2升的密闭容器中,充入2molSO2和lmolO2发生上述反应,当反应进行到2分钟末时达到平衡,平衡混合物中SO3的质量分数为50%,则反应前2分钟内用SO2表示的平均反应速率为_____,SO2的转化率为____,此时反应的平衡常数为_________。 (2)在某恒温、恒压容器中,按体积比2: 1加入SO2和O2进行上述反应,达到平衡后,再向容器中充入适量SO3(g),达到新平衡时,c(O2)将比原平衡_____(填“增大”、“减小”、或“不变”) (3)若在某恒温、恒容容器中,加入一定量SO3(g)发生上述反应,达到平衡后,再向容器 中充入适量SO3(g),达到新平衡时,c(SO2)/c(SO3)将比原平衡______(填“增大”、“减小”、或“不变”)。 |
|
| 27. 填空题 | 详细信息 |
|
CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为: ①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1 ②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1 ③C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1 (1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3kJ。 (2)甲烷与CO2可用于合成水煤气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1gCH4完全反应可释放15.46kJ的热量,则: ①能表示该反应过程中能量变化的是________(填字母)。 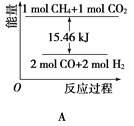 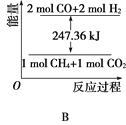 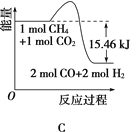 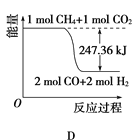 ②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为________。 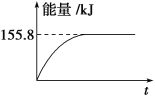 (3)C(s)与H2 (g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH=_____。 (4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_______(填字母)。 A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量 B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2 C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成水煤气(CO、H2) D.将固态碳合成为C60,以C60作为燃料 |
|
| 28. 填空题 | 详细信息 |
某课外活动小组同学用下图装置进行实验,试回答下列问题: Ⅰ.以图1的实验装置进行实验。 (1)若开始时打开开关K2,闭合开关K1,则该装置为__________(填装置名称)。 (2)若开始时打开开关K1,闭合开关K2,则: ①U型管里总反应的离子方程式为____________________。 ②对于上述实验,下列说法正确的是_________(填序号)。 A.溶液中Na+向B极移动 B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 D.若标准状况下从A极逸出2.24L气体,则外电路上通过的电子数目约为0.2NA Ⅱ.以图2的实验装置进行实验。 (3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。 ①该电解槽的阳极反应式为___________________。单位时间内通过阴离子交换膜的离子数______(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。 ②从出口D导出的溶液是____(填化学式)。 |
|
| 29. 实验题 | 详细信息 | ||||||||||||||||||||||||
某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
|
|||||||||||||||||||||||||



