2019-2020年高二上半年期中考试化学题开卷有益(甘肃省白银市会宁县第四中学)
| 1. 选择题 | 详细信息 |
|
未来新能源的特点是来源丰富,在使用时对环境无污染或污染很小,且可以再生。下列满足未来新能源标准的是( ) ①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢 A. ①②③④ B. ③⑤⑥⑦ C. ④⑤⑥⑦ D. ③④⑤⑥⑦ |
|
| 2. 选择题 | 详细信息 |
|
下列热化学方程式中,△H能正确表示物质的燃烧热的是 A.2CO(g) +O2(g) =2CO2(g) △H=—566.0 kJ/mol B.C(s) +1/2O2(g) =CO(g) △H=—110.5 kJ/mol C.CH4(g) +2O2(g)= CO2(g)+2H2O(l) △H=—890.31 kJ/mol D.2C8H18(l) +25O2(g)=16CO2(g)+18H2O(l) △H=—11036 kJ/mol |
|
| 3. 选择题 | 详细信息 |
|
下列说法正确的是 A.需要加热方能发生的反应一定是吸热反应 B.放热的反应在常温下一定很易发生 C.一个反应是放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定,而不是由反应是否需要加热而决定 D.吸热反应发生过程中要不断从外界获得能量、放热反应发生过程中不再需要外界能量 |
|
| 4. 选择题 | 详细信息 |
|
属于吸热反应的是( ) A.铝跟盐酸反应 B.Ba(OH)2•8H2O与NH4Cl反应 C.盐酸与氢氧化钠溶液反应 D.酒精的燃烧 |
|
| 5. 选择题 | 详细信息 |
|
已知C(s,石墨)=C(s,金刚石) ∆H>0,下列判断正确的是( ) A.此反应为放热反应 B.断裂1mol石墨的化学键需要吸收的能量小于生成1mol金刚石化学键所放出的能量 C.石墨比金刚石稳定 D.此变化为物理变化 |
|
| 6. 选择题 | 详细信息 |
|
已知H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol,则 A.+184.6kJ/mol B.-92.3kJ/mol C.-369.2kJ/mol D.+92.3kJ/mol |
|
| 7. 选择题 | 详细信息 |
|
少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( ) ①加H2O ②加NaOH固体③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸 A. ①⑥⑦ B. ③⑤⑧ C. ③⑦⑧ D. ⑥⑦⑧ |
|
| 8. 选择题 | 详细信息 |
|
已知4NH3+5O2 A.4v(NH3)=5v(O2) B.5v(O2)=6v(H2O) C.4v(NH3)=6v(H2O) D.4v(O2)= 5v(NO) |
|
| 9. 选择题 | 详细信息 |
|
已知CH4(g)+2O2(g)=CO2(g)+2H2O(l),△H=-Q1kJ•mol-1; 2H2(g)+O2(g)=2H2O(g),△H=-Q2kJ•mol-1; 2H2(g)+O2(g)=2H2O(l),△H2=-Q3kJ•mol-1。 常温下,取体积比4∶1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为 A.0.4Q1+0.05Q3 B.0.4Q1+0.05Q2 C.0.4Q1+0.1Q3 D.0.4Q1+0.2Q2 |
|
| 10. 选择题 | 详细信息 |
|
对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知 A.化学反应速率变化时,化学平衡一定发生移动 B.化学平衡发生移动时,化学反应速率一定变化 C.正反应进行的程度大,正反应速率一定大 D.只有在催化剂存在条件下,才会发生化学反应速率变化而化学平衡不移动的情况 |
|
| 11. 选择题 | 详细信息 |
|
在某温度下,可逆反应mA(g)+nB(g) A. K越大,达到平衡时,反应进行的程度越大 B. K越小,达到平衡时,反应物的转化率越大 C. K随反应物浓度的改变而改变 D. K随温度和压强的改变而一定改变 |
|
| 12. 选择题 | 详细信息 |
在a、b两个相同的容器中,分别加入相同量的A和B,发生可逆反应:A(g)+3B(g) A.a的温度高于b B.a使用了催化剂,而b未用 C.a的压强大于b D.a的温度低于b |
|
| 13. 选择题 | 详细信息 |
|
在一定温度下,一定体积的的密闭容器中有如下平衡:H2(g)+I2(g) A.0.16 B.0.08 C.0.04 D.0.02 |
|
| 14. 选择题 | 详细信息 |
|
下列有关化学研究的正确说法是 A.同时改变两个变量来研究反应速率的变化,能更快得出有关规律 B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 C.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2 D.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
|
| 15. 选择题 | 详细信息 |
反应N2(g)+3H2(g)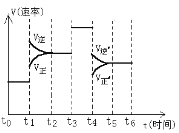 A. t5~t6时氨气的体积分数最大 B. t3时升高了温度 C. t1时加入催化剂 D. t4时减小压强 |
|
| 16. 选择题 | 详细信息 |
某实验小组学生用50 mL 0.50 mol·L−1盐酸与50 mL 0.55 mol·L−1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量计算中和热。下列说法正确的是 A. 实验过程中没有热量损失 B. 图中实验装置缺少环形玻璃搅拌棒 C. 烧杯间填满碎泡沫塑料的作用是固定小烧杯 D. 酸或碱的物质的量越大,所测中和热的数值越大 |
|
| 17. 选择题 | 详细信息 |
|
反应X(g)+Y(g) A. 减小容器体积,平衡向右移动 B. 加入催化剂,Z的产率增大 C. 增大c(X),X的转化率增大 D. 降低温度,Y的转化率增大 |
|
| 18. 选择题 | 详细信息 |
|
常温下,下列变化过程不是自发的是 A.石灰石的分解 B.原电池产生电流 C.在密闭条件下体系从有序变为无序 D.铁在潮湿空气中生锈 |
|
| 19. 选择题 | 详细信息 |
|
反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是 A. 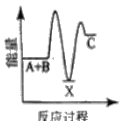 B. B. 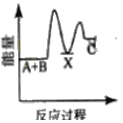 C.  D. D.  |
|
| 20. 选择题 | 详细信息 |
|
一定量的混合气体在密闭容器中发生反应 m A (g) + n B (g) A. m + n > p B. C的体积分数增加 C. 平衡向正反应方向移动 D. A 的转化率降低 |
|
| 21. 选择题 | 详细信息 |
|
在温度压强不变时,1mol NO2高温分解,生成NO和O2,达到平衡时容器内气体的物质的量变为1.2mol,这时NO2的转化率为 A. 10% B. 20% C. 40% D. 50% |
|
| 22. 选择题 | 详细信息 |
|
下列措施或事实不能用勒夏特列原理解释的是( ) A.滴加酚酞的氨水中加入氯化铵固体后红色变浅 B.棕红色的NO2加压后颜色先变深后变浅(已知:2NO2(g) C.煅烧粉碎的硫铁矿利于SO2的生成 D.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 |
|
| 23. 选择题 | 详细信息 |
|
在一定条件下NO2与SO2气体发生反应,NO2(g)+SO2(g) A.混合气体颜色保持不变 B.体系压强保持不变 C.SO3和NO的体积比保持不变 D.每消耗1 mol SO3的同时生成1 mol NO2 |
|
| 24. 选择题 | 详细信息 |
在恒容密闭容器中通入X并发生反应:2X(g)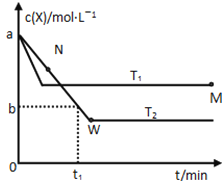 A.该反应进行到M点放出的热量大于进行到W点放出的热量 B.T2下,在0~t1时间内,υ(Y)= C.M点的正反应速率υ正大于N点的逆反应速率υ逆 D.M点时再加入一定量的X,平衡后X的转化率减小 |
|
| 25. 综合题 | 详细信息 |
|
(1)在25℃、1.01×105Pa时,16g S粉在足量的氧气中充分燃烧生成二氧化硫气体,放出148.5kJ的热量,则S的燃烧热的热化学方程式为:___。 (2)1L1mol/L稀盐酸跟1L1mol/LNaOH溶液起中和反应放出57.3kJ热量,其热化学方程式为:___。 (3)已知如图所示的可逆反应: 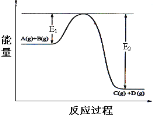 ①A(g)+B(g) ②反应体系中加入催化剂,反应速率增大,则E1的变化是:E1___,ΔH的变化是:ΔH___(填“增大”“减小”“不变”)。 (4)发射卫星用N2H4作燃料,NO2作氧化剂,两者反应生成N2和水蒸气, 已知:N2(g)+2O2(g)=2NO2(g) △H1=+67.7kJ/mol N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=-534kJ/mol 则1mol气体肼和NO2完全反应时的反应热△H=___kJ/mol。 (5)已知反应A放出热量Q1kJ,焓变为△H1,反应B放出热量Q2kJ,焓变为△H2,若Q1>Q2,则△H1___△H2 (6)1molC与1molH2O(g)反应生成1molCO(g)和1molH2(g),需吸收131.5kJ的热量,该反应的反应热为△H=___kJ/mol; (7)反应A+3B=2C+2D在四种不同情况下的反应速率分别为: ①v(A)=0.15mol/(L・s) ②v(B)=0.6mol/(L・s) ③v(C)=0.4mol/(L・s) ④v(D)=0.45mol(L・s) 则该反应进行最快的为___(填序号) |
|
| 26. 综合题 | 详细信息 |
|
化学平衡原理在工农业生产中发挥着重要的指导作用。 (1)反应C(s)+CO2(g) (2)已知某温度下,反应2SO2(g)+O2(g) (3)对于可逆反应:aA(g) +bB(g) (4)在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则 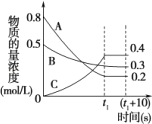 ①该反应的化学方程式为:___; ②t1s时反应物A的转化率为:___; ③0~t1s内A的反应速率为v(A)=___。 |
|
| 27. 综合题 | 详细信息 |
已知NO2和N2O4可以相互转化:2NO2(g)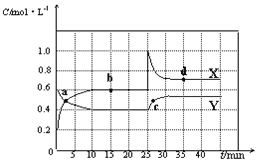 (1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是___;a、b、c、d四个点中,表示化学反应处于平衡状态的点是___。 (2)前10min内用NO2表示的化学反应速率v(NO2)=___mol·L-1·min-1。 (3)①据图分析,在25min时采取的措施是___(填序号)。 A.加入催化剂 B.缩小容器体积 C.加入一定量的NO2 D.加入一定量的N2O4 ②若在35 min时,保持温度不变,快速缩小容器的体积至1L,气体的颜色变化过程是___。 |
|
| 28. 填空题 | 详细信息 | ||||||||||||||||||||
某学生做浓度对化学反应速率的影响实验时,将3支试管编号为①②③,并按下表中的物质的量进行实验,记录的时间数据是16s、28s、33s。请据3个时间数据填入适当位置,并写出实验结论。
|
|||||||||||||||||||||
最近更新



