2018年至2019年高二3月月考化学试卷(新疆乌鲁木齐市23中学)
| 1. 选择题 | 详细信息 |
|
关于晶体的下列说法中正确的是 A. 溶质从溶液中析出是得到晶体的三条途径之一 B. 区别晶体和非晶体最好的方法是观察是否有规则的几何外形 C. 水晶在不同方向上的硬度、导热性、导电性相同 D. 只有无色透明的固体才是晶体 |
|
| 2. 选择题 | 详细信息 |
|
关于原子轨道的说法正确的是 A. 凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体 B. CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和1个C原子的2p轨道混合起来而形成的 C. sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道 D. 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
|
| 3. 选择题 | 详细信息 |
|
Co(Ⅲ)的八面体配合物CoClm·nNH3,若1 mol配合物与AgNO3作用生成1 mol AgCl沉淀,则m、n的值是( ) A. m=1,n=5 B. m=3,n=4 C. m=5,n=1 D. m=4,n=5 |
|
| 4. 选择题 | 详细信息 |
|
根据价层电子对互斥模型,判断下列分子或者离子的空间构型不是三角锥形的( ) A. PCl3 B. H3O+ C. HCHO D. PH3 |
|
| 5. 选择题 | 详细信息 |
CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22﹣存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )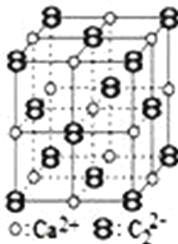 A. 1 个 Ca2+周围距离最近且等距离的 C22﹣数目为 6 B. 该晶体中的阴离子与F2是等电子体 C. 6.4 g CaC2晶体中含阴离子0.1 mol D. 与每个Ca2+距离相等且最近的Ca2+共有12个 |
|
| 6. 选择题 | 详细信息 |
|
下列有关离子晶体的数据大小比较不正确的是( ) A. 熔点:NaF>MgF2>AlF3 B. 晶格能:NaF>NaCl>NaBr C. 阴离子的配位数:CsCl>NaCl>CaF2 D. 硬度:MgO>CaO>BaO |
|
| 7. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A.一个CsCl晶胞中含有8个Cl-。 B.离子晶体类的物质均是电解质,故离子晶体均能导电。 C.锗和碳都存在具有原子晶体结构的单质,锗和碳都易形成四个键,能形成原子晶体结构。 D.某物质是由X(黑球)、Y(白球)两种微粒构成的,它们在二维平面中的排列情况为 |
|
| 8. 选择题 | 详细信息 |
|
下列叙述不正确的是 ( ) A.金刚石的一个晶胞中含有6个碳原子。 B.12 g石墨中六元环的数目为0.5NA。 C.1个干冰晶胞的质量为 D.以面心立方最密堆积形成的晶胞中金属含有4个金属原子。 |
|
| 9. 综合题 | 详细信息 |
|
按要求回答问题: (1)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。 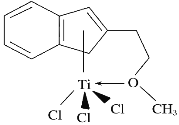 组成M的元素中,电负性最大的是__________(填名称)。 (2)钛元素基态原子未成对电子数为________个,能量最高的电子占据的能级符号为________。 (3)①已知Al 的第一电离能为578 kJ·mol-1、第二电离能为1 817 kJ·mol-1、第三电离能为2 745 kJ·mol-1、第四电离能为11 575 kJ·mol-1。请解释其第二电离能增幅较大_______________________________。Al单质为面心立方晶体,其晶胞参数a=0.405 nm,晶胞中铝原子的配位数为________。 ②第二电离能I(Cu)________(填“>”或“<”)I (Zn)。 (4)在硅酸盐中,SiO44—四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。 图(b)为一种无限长单链结构的多硅酸根(其中硅原子数为n):其中Si原子的杂化形式为_________,Si与O的原子数之比为__________,化学式为____________。 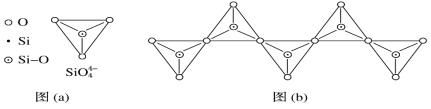 |
|
| 10. 综合题 | 详细信息 |
|
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题: (1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区分晶体、准晶体和非晶体。 (2)基态K原子中,核外电子排布图是_________,占据最高能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是______________________________________。 (3)测定发现I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化类型为________________。 (4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。 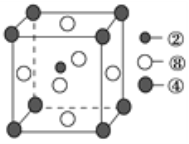 (5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。 |
|
| 11. 综合题 | 详细信息 |
|
东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题: (1)镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为_______。 (2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。 ①[Ni(NH3)6]SO4中阴离子的立体构型是________。 ②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是______。 ③氨的沸点_______(填“高于”或“低于”)膦(PH3),原因是_______;氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。 (3)铜晶体铜碳原子的堆积方式如图所示。 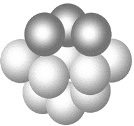 ①基态铜在元素周期表中位置__________________。 ②每个铜原子周围距离最近的铜原子数目_________。 (4)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。 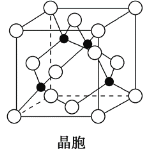 ①该晶体的化学式为__________________。 ②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于________(填“离子”或“共价”)化合物。 ③已知该晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为________pm(只写计算式)。 |
|
| 12. 综合题 | 详细信息 |
|
(Ⅰ)下列叙述正确的有_______________ A.第四周期元素中,锰原子价电子层中未成对电子数最多 B.第二周期主族元素的原子半径随核电荷数增大依次减小 C.卤素氢化物中,HCl的沸点最低的原因是其分子间的范德华力最小 (Ⅱ)M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题: (1)单质M的晶体类型为______,晶体中原子间通过_____作用形成面心立方密堆积,其中M原子的配位数为______。 (2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。 (3)M与Y形成的一种化合物的立方晶胞如图所示。 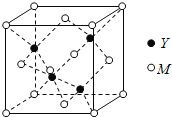 ①该化合物的化学式为_______,已知晶胞参数a=0.542 nm,此晶体的密度为_______g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA) ②该化合物难溶于水但易溶于氨水,其原因是________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______。 |
|
| 13. 综合题 | 详细信息 |
|
(1)1mol乙醛分子中含有σ键的数目为________,乙酸的沸点明显高于乙醛,其主要原因是____________________________________________。 (2)与OH-互为等电子体的一种分子为________________(填化学式)。 (3)短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p能级与所有s能级电子总数相等,D元素原子的L层的p能级中有3个未成对电子。 ①C元素原子基态时的价电子排布式为________,若A元素为非金属元素,A与C形成的化合物中的共价键属于________键(填“σ”或“π”)。 ②当n=2时,B的最简单气态氢化物的分子构型为________,中心原子的杂化方式为________,BC2属于________分子(填“极性”或“非极性”),当n=3时,B与C形成的晶体属于________晶体。 (4)BF3与一定量的水形成晶体Q[(H2O)2·BF3],Q在一定条件下可转化为R: 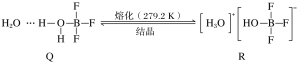 晶体Q中各种微粒间的作用力不涉及________(填序号)。 a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力 (5)已知苯酚( |
|
最近更新



