山西省忻州市第一中学2020-2021年高二上期开学考试化学试卷在线练习
| 1. 选择题 | 详细信息 |
|
化学与生产、生活、社会密切相关。下列有关说法正确的是 A.煤经过气化和液化等物理变化可转化为清洁燃料 B.为了提高酒精的杀菌消毒效果,医院常用体积分数为100%的酒精 C.用浸泡过酸性高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 D.不粘锅的原料CF2=CF2为烃类化合物 |
|
| 2. 选择题 | 详细信息 |
|
下列化学用语正确的是( ) A.结构简式(CH3)2CHCH3既可以表示正丁烷,也可以表示异丁烷 B.丙烷分子的比例模型: C.甲烷分子的球棍模型: 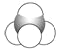 D.乙烷分子的电子式: 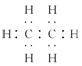 |
|
| 3. 选择题 | 详细信息 |
|
硫酸亚铁铵受热分解的反应方程式为2(NH4)2Fe(SO4)2 A. 1 L 0.1 mol·L−1 (NH4)2Fe(SO4)2溶液中Fe2+的数目为0.1NA B. 将1 mol SO2和1 mol O2充分反应后,其分子总数为1.5NA C. 标准状况下,每生成15.68 L气体转移电子数目为0.8NA D. 常温常压下,3.0 g 15N2中含有的中子总数为1.4NA |
|
| 4. 选择题 | 详细信息 |
|
下列反应的离子方程式正确的是 A.向明矾溶液中滴加Ba(OH)2溶液恰好使 B.将SO2气体通入NaClO溶液中:SO2+ 2ClO- +H2O= C.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2 D.VO2+与酸性高锰酸钾溶液反应:5VO2++ |
|
| 5. 选择题 | 详细信息 | ||||||||
短周期主族元素X、Y、Z、Q的原子序数依次增大,它们在元素周期表中的相对位置如图所示。X的最外层电子数是内层电子数的两倍,Y、Z属于同主族,下列说法正确的是
|
|||||||||
| 6. 选择题 | 详细信息 |
|
下列说法正确的是 A.用溴水可以鉴别已烯、己烷、四氯化碳三种有机物 B.利用油脂在碱性条件下水解,可以得到甘油和高级脂肪酸 C.油脂、纤维素、淀粉和蛋白质都是高分子化合物 D.1 mol苯恰好与3 mol氢气完全加成,说明一个苯分子中有三个碳碳双键 |
|
| 7. 选择题 | 详细信息 |
环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的黏结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂中间产物的合成路线: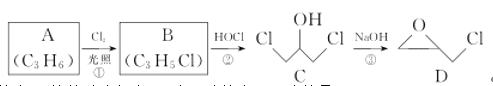 其中A能使溴水褪色,则下列说法不正确的是 A.反应①是取代反应 B.A使溴水褪色是因为发生了加成反应 C.B的结构简式为CH3- CH=CHCl D.C可以发生酯化反应 |
|
| 8. 选择题 | 详细信息 |
海水开发利用的部分过程如图所示。下列说法错误的是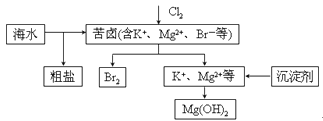 A. 向苦卤中通入Cl2是为了提取溴 B. 粗盐可采用除杂和重结晶等过程提纯 C. 工业生产中常选用NaOH作为沉淀剂 D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
|
| 9. 选择题 | 详细信息 |
|
下列叙述不正确的是( )。 A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 B.分子式符合 C.已知二氯苯有3种结构,则四氯苯也有3种结构 D.菲的结构简式为 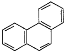 ,一定条件下,它与硝酸反应,可生成5种一硝基取代物 ,一定条件下,它与硝酸反应,可生成5种一硝基取代物 |
|
| 10. 选择题 | 详细信息 |
|
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为:①v(A)=0.45mol/(L·s) ②v(B)=0.6mol/(L·s) ③v(C)=0.4mol/(L·s) ④v(D)=0.45mol/(L·s)。下列有关反应速率的比较中正确的是( ) A.④>③=②>① B.①>④>②=③ C.①>②>③>④ D.④>③>②>① |
|
| 11. 选择题 | 详细信息 | ||||||||
已知:断开或形成1 mol共价键吸收或放出的能量数据如下表。
|
|||||||||
| 12. 选择题 | 详细信息 |
|
溴与氢气在一定条件下反应的热化学方程式如下: ①Br2(g)+ H2(g)⇌2HBr(g) △H=-Q1 kJ·mol-1 ②Br2(l)+ H2(g)⇌2HBr(g) △H =-Q2 kJ·mol-1 下列说法正确的是 A.Q1<Q2 B.1 mol HBr(g)具有的能量大于1mol HBr(l)具有的能量 C.相同条件下,Cl2(g)+ H2(g)⇌2HCl(g) △H >-Q1 kJ·mol-1 D.向1 mol Br2(g)中加入1 mol H2(g)在该条件下充分反应,放出Q1 kJ热量 |
|
| 13. 选择题 | 详细信息 |
利用“Na—CO2”电池可将 CO2 变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电时总反应的化学方程式为 4Na+3CO2=2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中不正确的是 A.电流流向为 MWCNT→导线→钠箔 B.放电时,正极的电极反应式为 3CO2+4Na++4e-=2Na2 CO3+C C.选用高氯酸钠—四甘醇二甲醚作电解液的优点是导电性好,不与金属钠反应,难挥发 D.原两电极质量相等,若生成的Na2CO3 和C 全部沉积在电极表面,当转移 0.2 mol e-时,两极的质量差为 11.2 g |
|
| 14. 选择题 | 详细信息 | ||||||||||||
80℃时,NO2(g)+SO2(g)
A.平衡时,乙中SO2的转化率大于50% |
|||||||||||||
| 15. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
下表是元素周期表的一-部分,其中每个数字序号代表一种短周期元素。根据表中所列①~⑩元素,请按要求回答下列问题:
已知:A是石油裂解气的主要成分,A的产量常用来衡量一个国家石油化工的发展水平。现以A为主要原料合成E,其合成路线如图所示: 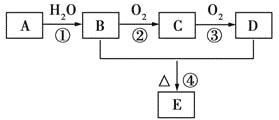 请回答下列问题: (1)B、D中官能团的名称分别是____。 (2)写出下列反应的化学方程式及其反应类型: ①______________________________ _____反应; ②______________________________________________________________反应。 (3)E有多种同分异构体,请写出其中能与碳酸钠溶液反应产生气体的所有同分异构体的结构简式:___________。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16. | 详细信息 |
燃料电池作为安全性能较好的一类化学电源得到了广泛的应用。可作燃料的物质有甲烷、肼(H2N-NH2)等,燃料电池结构如图所示。 (1)在常温下,甲烷的燃烧热△H为-890.31 kJ/mol,写出甲烷燃烧的热化学方程式:_____。 (2)若X溶液为NaOH溶液,Y发生氧化反应,则Y为___(填“甲烷”或“氧气”),a电极的电极反应式为_____。 (3)若用肼作燃料,负极的电极反应式为N2H4-4e-+4OH-=4H2O+N2↑ 。 ①N2的电子式是______。 ②根据上述肼的电极反应式,X可能是_____(填“NaOH”或“H2SO4”)。 ③每转移2 mol电子时,产生标准状况下N2的体积是_______。 |
|
| 17. | 详细信息 | ||||||||
|
某化学小组在实验室制取Na2O2。 查阅资料可知,温度在573~673 K之间可生成Na2O2,若温度提高到733 K以上Na2O2会分解。除Li外其他碱金属不与N2反应。 (1)甲组同学设计制取Na2O2的装置如图。 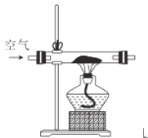 ①使用该装置制取的Na2O2中不可能含有的杂质为______。 A. Na3N B. Na2CO3 C. Na2O D. NaOH ②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:  烧瓶中发生的主要反应的化学方程式是_____。水槽中量筒中收集到的气体为_____。测定装置的接口从左至右正确的连接顺序是_____。 (2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果____(填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如下:
实验方案I中发生反应的化学方程式为_______。 根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是______。 |
|||||||||
| 18. | 详细信息 |
|
CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的实现具有重要的意义。 (1)金刚石和石墨的燃烧反应中的能量变化如图所示。 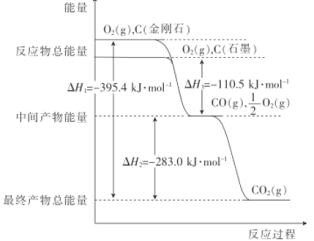 ①金刚石的燃烧热△H为____kJ ·mol-1;石墨不完全燃烧生成CO的热化学方程式为____。 ②下列说法中正确的是___。 A.石墨和金刚石互为同素异形体 B.石墨转化为金刚石要放出能量 C.等质量的石墨与金刚石完全燃烧,石墨放出的能量多 D.通常状况下,石墨比金刚石稳定 ③石墨转化为金刚石的热化学方程式为____。 (2)以CO2为原料还可合成多种物质,工业上常以CO2(g)与H2(g) 为原料合成乙醇。 已知:CO(g)+ H2O(l)⇌CO2(g)+H2(g) △H=+2.8 kJ·mol-1; 2CO(g) +4H2(g)⇌CH3CH2OH(g)+H2O(l) △H=-300.1 kJ·mol-1。 则2CO2(g) +6H2(g)⇌CH3CH2OH(g) +3H2O(l) △H=______。 |
|
| 19. | 详细信息 | ||||||||||||||||||
在1.0 L真空密闭容器中充入4.0 mol A(g)和4.0 mol B(g),在一定温度下进行反.应:A(g)+B(g)⇌C(g) △H,测得不同时刻该容器内物质的物质的量如下表:
|
|||||||||||||||||||




