天津市2018年高三化学下期月考测验试卷带答案和解析
| 1. 选择题 | 详细信息 |
|
下列说法正确的是 A. PE(聚乙烯)材料因其无毒且易降解,广泛用于食品包装 B. “投泥泼水愈光明”中蕴含的化学反应是炭与灼热水蒸气反应得到两种可燃性气体 C. “一带一路”被誉为现代“丝绸之路”。丝绸来自合成纤维,主要含C、H、O、N元素 D. 《天工开物》记裁制造青瓦“(窑)泥周寒其孔,浇水转釉”,红瓦转化为青瓦的原因是铁的其他氧化物转化为Fe2O3 |
|
| 2. 选择题 | 详细信息 |
|
下列说法正确的是 A. 天然气、液化石油气属于清洁能源 B. 获得芳香烃的主要途径是石油的催化重整,通过煤的分馏也可以获得各种芳香烃 C. 石油裂化的目的是使长链烃分子断裂为短链烃分子 D. 酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差 |
|
| 3. 选择题 | 详细信息 |
|
X、Y、Z、W是原子序数依次增大的常见短周期元素,X的某种氢化物能使湿润的红色石蕊试纸变蓝.Y的一种核素质量数为18,中子数为10.在同周期元素中Z的简单离子半径最小,W的单质是良好的半导体材料。下列说法中正确的是 A. 简单气态氢化物稳定性:W >X B. Y元素的相对原子质量为18 C. X2H4的分子中极性键和非极性键数目比为4:l D. 电解Z的熔融氯化物可以冶炼单质Z |
|
| 4. 选择题 | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列叙述中正确的是 A. 1L0.lmol/L的Na2CO3溶液中含阴离子总数为0.1 NA个 B. 0.1mol的2H35Cl分子的中子数是2NA C. 1mol Na2O2与足量CO2反应时转移的电子数目为2NA D. 加热条件下,0.2mol 锌与足量一定浓度的硫酸反应,产生4.48L气体(标况) |
|
| 5. 选择题 | 详细信息 |
(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是 的关系如图所示。下列说法正确的是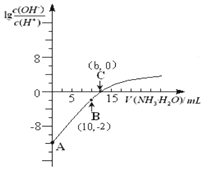 A. H2A的电离方程式为H2A B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-) D. 25℃时,该氨水的电离平衡常数为 |
|
| 6. | 详细信息 |
SiCl4是一种遇水强烈水解,并放出大量的热的化合物。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)来制备BaCl2·2H2O,工艺流程如下: 已知:①常温下Fe3+ 、Mg2+ 完全沉淀的 pH 分别是3.4、12.4。 ②Ge与Si同主族位于Si的下一周期。 (1)Ge的原子序数________ (2)请用电子式表示C2H2的形成过程_____________________________。 (3)SiCl4发生水解反应的化学方程式____________________________。 (4)氮化硅(Si3N4)是一种高温结构材料,粉末状的Si3N4可以在高温条件下由SiCl4蒸汽与NH3反应得到,请写出该反应的化学方程式_____________________________________。 (5)加钡矿粉调节pH=7的作用是:①使BaCO3转化为BaCl2;②________________________ (6)生成滤渣A的离子方程式:______________________________; (7)BaCl2滤液经__________、__________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。 (8)10 吨含78.8% BaCO3的钡矿粉理论上最多能生成 BaCl2·2H2O___________吨。 |
|
| 7. 填空题 | 详细信息 |
卡托普利是治疗各种原发性高血压的药物,其以乙烯为主要原料合成路线如下: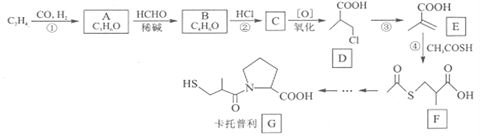 已知:R1-CHO+ 回答下列问题: (1)E的名称为________________,A中官能团的名称:______________________。 (2)反应④的类型为________________,反应③的条件为____________________。 (3)下列关于卡托普利说法正确的是________ a.能发生取代反应 b.在氧气中充分燃烧的产物中含有SO2 c.能与Na反应生成氢气 d.卡托普利的分子式为C9H16NO3S (4)有机物H与F互为同系物( (5)写出A与新制氢氧化铜悬浊液反应的化学方程式____________________________________。 (6)写出以物质B和乙醛为主要原料制备 |
|
| 8. 实验题 | 详细信息 | ||||||||
某化学小组在实验室制取Na2O2。查阅资料可知,钠与空气在453~473 K之间可生成Na2O,迅速提高温度到573~673 K之间可生成Na2O2,若温度提高到733~873 K之间Na2O2可分解。除Li外其他碱金属不与N2反应。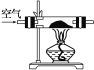 (1)甲组设计制取Na2O2装置如图。 ①使用该装置制取的Na2O2中可能含有的杂质为________。 A.Na3N B.Na2CO3 C.Na2O D.NaOH E.NaHCO3 ②该小组为测定制得的Na2O2样品的纯度,设计装置如下: 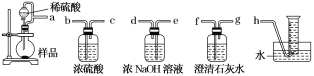 烧瓶中发生的主要反应的化学方程式是______________________。分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果________(填“偏大”“偏小”或“无影响”)。测定装置的接口从左至右正确的连接顺序是________。 (2)乙组从反应历程上分析该测定反应存在中间产物,从而导致测定结果________(填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如下:
|
|||||||||
| 9. 填空题 | 详细信息 | ||||||||
|
(1)下列说法正确的是_________ a.向0.1mol/L 100mL CH3COONa的溶液中再加0.1mol CH3COONa(s)后CH3COO-/Na+ 变大 b.向0.1mol/L的二元弱酸盐Na2A中不断通入HCl(g),,则c(H+)/c(H2A)先变大后变小 c.已知:FeCl3(aq)+ 3KSCN(aq) d.室温时,0.1mol/L NH4HCO3溶液PH=8.1,则Ka1(H2CO3) >Kb(NH3·H2O)>Ka2(H2CO3) (2)碳酸钠作固硫剂并用氢还原辉钼矿的原理为: MoOS2(s)+4H2(g)+2Na2CO3(s)⇌MoO(s)+2CO(g)+4H2O(g)+2Na2S(s)△H.实验测得平衡时的有关变化曲线如图所示。 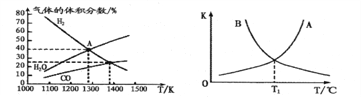 图1:温度与平衡时气体成分的关系图2:正、逆反应的平衡常数(K)与温度(T)的关系 ①一定温度下,在体积为固定的密闭容器中进行上述反应,下列能说明反应达到了平衡状态的是__(填序号)。 A.2v正(H2)=v逆(CO) B.CO体积分数保持不变 C.混合气体的平均相对分子质量不再变化 D.△H不再变化 ②图1中A点对应的平衡常数Kp= _________________(已知A点压强为0. lMPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。 ③综合上述分析得到:图2中,其中表示逆反应的平衡常数(K逆)的曲线是________(填“A”或“B”),T1对应的平衡常数为__________。 (3)水合肼(N2H4·H2O)常用作锅炉水的除氧剂。N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为N2H4·H2O (4)氨是一种重要的氮肥。工业合成氨反应为:1/2 N2(g)+ 3/2 H2(g)
|
|||||||||
最近更新



