昭通市高二化学上册期末考试试卷带参考答案和解析
| 1. 选择题 | 详细信息 |
|
依据价层电子对互斥理论判断SO2的分子构型 A. 正四面体形 B. 平面三角形 C. 三角锥形 D. V形 |
|
| 2. 选择题 | 详细信息 |
|
在以离子键为主的化学键中常含有共价键的成分,两种元素的电负性差异越小,其共价键成分越大。下列各对原子形成的化学键中共价键成分最多的是( ) A. K与F B. Na与Cl C. Al与S D. Mg与Cl |
|
| 3. 选择题 | 详细信息 |
|
对原子核外的电子运动描述方法正确的是 A. 根据一定的数据计算出它们某一时刻所在的位置 B. 用一定仪器测定或描述出它们的运动轨道 C. 核外电子的运动有确定的轨道 D. 核外电子的运动根本不具有宏观物体运动规律,只能用统计规律来描述 |
|
| 4. 选择题 | 详细信息 |
|
下列有关晶体的叙述中,正确的是( ) A. 在Si晶体中,Si原子与Si﹣Si键之比为1:4 B. 在NaCl晶体中,每个Na+周围距离最近的Na+有6个 C. 在CsCl晶体中,与每个Cs+紧邻的Cs+有8个 D. 在面心立方堆积的金属晶体中,每个金属原子周围紧邻的有12个金属原子 |
|
| 5. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 第三能层有s、p共两个能级 B. 3d能级最多容纳5个电子 C. 第三能层最多容纳8个电子 D. 无论哪一能层的s能级最多容纳的电子数均为2个 |
|
| 6. 选择题 | 详细信息 |
高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( ) A. KO2中只存在离子键 B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2- C. 晶体中与每个K+距离最近的O2-有6个 D. 晶体中,所有原子之间都以离子键相结合 |
|
| 7. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 第三周期所含的元素中钠的第一电离能最小 B. 铝的第一电离能比镁的第一电离能大 C. 在所有元素中,氟的第一电离能最大 D. 钾的第一电离能比镁的第一电离能大 |
|
| 8. 选择题 | 详细信息 |
|
若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用依次是 A.氢键;分子间作用力;极性键 B.氢键;氢键;非极性键 C.氢键;极性键;分子间作用力 D.分子间作用力;氢键;非极性键 |
|
| 9. 选择题 | 详细信息 |
|
已知NH3分子可与Cu2+形成配位化合物离子[Cu(NH3)4] 2+, 则除去硫酸铜溶液中少量硫酸可选用的试剂是 A. NaOH B. NH3 C. BaCl2 D. Cu(OH) 2 |
|
| 10. 选择题 | 详细信息 |
|
元素X、Y、Z的原子序数之和为28,X+与Z2-具有相同的电子层结构,Y、Z在同一周期。下列推测错误的是( ) A. 原子半径:X>Y,离子半径:Z2->X+ B. X单质与Z单质反应的物质的量之比一定为2∶1 C. Y与Z形成的化合物ZY2中,Z为+2价 D. 所有元素中Y的气态氢化物稳定性最强 |
|
| 11. 选择题 | 详细信息 |
|
下列既有离子键又有共价键的化合物是( ) A. Na2O B. NaOH C. CaBr2 D. HF |
|
| 12. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A. 分子晶体中的每个分子内一定含有共价键 B. 原子晶体中的相邻原子间只存在非极性共价键 C. 离子晶体中可能含有共价键 D. 金属晶体的熔点和沸点都很高 |
|
| 13. 选择题 | 详细信息 |
|
冰箱制冷剂氟氯甲烷在高空受紫外线辐射时产生Cl原子,并能发生下列反应:Cl+O3→ClO+O2 ClO+O→Cl+O2,下列说法不正确的是( ) A.反应过程中将O3转变为O2 B.Cl原子是总反应的催化剂 C.氟氯甲烷是总反应的催化剂 D.Cl原子起分解O3的作用 |
|
| 14. 选择题 | 详细信息 |
|
下列有关有机物的说法不正确的是 A. 苯与浓溴水不能发生取代反应 B. 甲烷和苯都能发生取代反应 C. 己烷与苯可以用酸性高锰酸钾溶液区分 D. 甲苯上的所有原子不可能处于同一平面上 |
|
| 15. 选择题 | 详细信息 |
|
化学与生活密切相关,下列用途、性质或变化对应正确的是( ) A.利用粮食酿酒的化学过程包含:淀粉→葡萄糖→己醇 B.在月饼包装袋中放入生石灰:防止食物氧化变质 C.焰火的绚丽:说明只有金属单质能发生焰色反应 D.氢氧化铝用于治疗胃酸过多:氢氧化铝碱性强 |
|
| 16. 选择题 | 详细信息 |
|
下列说法正确的是 A. 油脂都不能使溴水褪色 B. 氨基酸是两性化合物,能与酸、碱反应生成盐 C. 福尔马林可用作食品防腐剂 D. 蔗糖和麦芽糖的水解产物都是葡萄糖 |
|
| 17. 选择题 | 详细信息 |
下图有机物的正确命名为 ( ) A.2-乙基-3,3-二甲基戊烷 B.3,3-二甲基-4-乙基戊烷 C.3,3,4-三甲基己烷 D.3,4,4-三甲基己烷 |
|
| 18. 选择题 | 详细信息 |
化合物丙可由如图反应得到,则丙的结构不可能是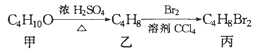 A. CH3CBr2CH2CH3 B. (CH3)CBrCH2Br C. CH3CH2CHBrCH2Br D. CH3(CHBr)2CH3 |
|
| 19. 选择题 | 详细信息 |
|
以下命题,违背化学变化规律的是( ) A. 石墨制成金刚石 B. 煤加氢变成人造石油 C. 水变成汽油 D. 海水淡化可以缓解淡水危机 |
|
| 20. 选择题 | 详细信息 |
|
下列表示物质结构的化学用语或模型正确的是( ) A.TNT的结构简式为:  B.苯乙醛的结构简式为: C.丙烷分子的球棍模型为:  D.乙烯的结构简式为:CH2CH2 |
|
| 21. 选择题 | 详细信息 |
有机物分子结构如图,其分子肯定可以共平面的碳原子有( ) A. 6个 B. 7个 C. 8个 D. 9个 |
|
| 22. 选择题 | 详细信息 |
|
下列关于有机物的说法中正确的是( ) A.石油的分馏和煤的干馏都是物理变化 B.塑料、橡胶和蚕丝都是合成高分子材料 C.淀粉、油脂、蛋白质在一定条件下都能发生水解 D.易溶于汽油、酒精、苯等有机溶剂的物质一定是有机物 |
|
| 23. 选择题 | 详细信息 |
|
下列卤代烃在KOH醇溶液中加热不发生消去反应的是( ) ①  ③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤ ③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤A.①③⑥ B.②③⑤ C.全部 D.②④ |
|
| 24. 选择题 | 详细信息 |
按如图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体是 A. H2 B. CH3CH2OH(气) C. CO2 D. CO和H2 |
|
| 25. 选择题 | 详细信息 |
|
下列有关有机物分离提纯的方法正确的是( ) A. 溴乙烷中混有溴单质,用NaOH溶液和水溶液,反复洗涤,再分液 B. 肥皂中混有甘油,加入NaCl粉末,盐析 C. 乙酸乙酯中混有乙酸,加入饱和Na2CO3溶液,充分反应后,再蒸馏 D. 乙醛中混有乙烯,可通过溴水,即可除去乙烯 |
|
| 26. 实验题 | 详细信息 |
实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。 请回答下列问题 (1)图甲中冷凝水从______(a或b)进,图乙中B装置的名称为_______; (2)图甲在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入沸石,目的是_______; (3)反应中加入过量的乙醇,目的是_______; (4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:  则试剂a是______,分离方法I是_______,分离方法II是_______,产物E是______。 |
|
| 27. 填空题 | 详细信息 |
现有几组物质的熔点(℃)的数据: 据此回答下列问题: (1)A组属于___________晶体,其熔化时克服的微粒间的作用力是__________________。 (2)B组晶体共同的物理性质是___________________(填序号)。 ①有金属光泽 ②导电性 ③导热性 ④延展性 (3)C组中HF熔点反常是由于_______________________________________。 (4)D组晶体可能具有的性质是_________________(填序号)。 ①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电 (5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为_______________________________。 |
|
| 28. 综合题 | 详细信息 |
|
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献. (1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:  4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是__. (2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.  ①写出基态Cu原子的核外电子排布式__;金属铜采用下列__(填字母代号)堆积方式.  ②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)__. ③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响__. ④SO42﹣的空间构型是________. |
|
| 29. 综合题 | 详细信息 |
|
I.已知: 烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3:4,与A相关的反应如下:  请回答下列问题: (1)A的分子式为__,B的名称是__; (2)写出C→D反应的化学方程式:__; (3)链烃M的相对分子质量比B多24,分子中所有碳原子均在同一平面上,其结构简式是__; Ⅱ.由E转化为对甲基苯乙炔(  (4)①反应中所加试剂是__; ③的反应类型是__; (5)写出G的结构简式:__; (6)写出两种同时符合下列条件的E的同分异构体的结构简式:__。 ①属于芳香醛; ②苯环上有两种不同环境的氢原子. |
|
| 30. 综合题 | 详细信息 |
|
有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素。X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子层排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第ⅠA族元素。回答下列问题: (1)基态G原子的价电子排布式为____________,写出第三周期基态原子未成对电子数与G相同且电负性最大的元素是________(填元素名称)。GQ受热分解生成G2Q和Q2,请从G的原子结构来说明GQ受热易分解的原因:_____________________________________________。 (2)Z、Q、M三种元素的第一电离能从大到小的顺序为____________(用元素符号表示)。 (3)X与Q形成的化合物的化学式为________。 (4)Z、M、E所形成的简单离子的半径由大到小顺序为____________(用离子符号表示)。 (5)X、Y、Z、Q的电负性由大到小的顺序为____________(用元素符号表示)。 |
|
| 31. 综合题 | 详细信息 |
|
回答下列问题。 (1)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质,下面给出14种元素的电负性。  ①判断下列化合物中属于离子化合物的是________(填字母); A.Mg3N2 B.BeCl2 C.AlCl3 D.SiC ②已知PCl3、NCl3均能发生水解反应,PCl3水解反应的化学方程式为__________________________;NCl3水解产物为____________________。 (2)观察Li、Be、Mg、Al在元素周期表中的位置回答: ①铍的最高价氧化物的水化物是________(填“酸性”、“碱性”或“两性”)化合物,证明这一结论的有关离子方程式是_____________________________________________________; ②根据Mg在空气中的燃烧情况,Li在空气中燃烧生成产物为__________(用化学式表示)。 (3)现有核电荷数小于20的元素A,其电离能数据如下:(I1表示原子失去第1个电子的电离能;In表示原子失去第n个电子的电离能,单位:1×102kJ·mol-1)  ①外层电子离核越远,能量越高,电离能越__________(填“大”或“小”);阳离子电荷数越高,失去电子时,电离能越________(填“大”或“小”); ②上述11个电子分属________个电子层; ③失去了11个电子后,该元素还有________个电子; ④该元素最高价氧化物对应水化物的化学式是______________________________________。 |
|
最近更新



