2019-2020年高一上册期中考试化学考试完整版(广西南宁市第三中学)
| 1. 选择题 | 详细信息 |
|
下列是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是( ) A.  B. B. C. C. D. D. |
|
| 2. 选择题 | 详细信息 |
|
下列说法中正确的是( ) A.氯化钠水溶液在电流的作用下电离出Na+和Cl- B.溶于水后能电离出氢离子的化合物可以是酸也可以是盐 C.硫酸溶液的导电性一定比醋酸溶液的导电性强 D.硫酸钠在水中的电离方程式可表示为Na2SO4=2Na++S6++4O2- |
|
| 3. 选择题 | 详细信息 |
|
以下实验装置一般不用于分离物质的是( ) A.  B. B. C. C. D. D. |
|
| 4. 选择题 | 详细信息 |
|
下列有关仪器的使用方法或实验操作正确的是( ) A.用量筒量取24.58mL的浓H2SO4倒入容量瓶中配制500mL的稀硫酸溶液 B.用苯萃取碘水后,先从分液漏斗下口将水放出,再从上口倒出I2的苯溶液 C.容量瓶、分液漏斗、长颈漏斗,使用前均需要验漏 D.洗净的锥形瓶和容量瓶可以放进烘箱中烘干 |
|
| 5. 选择题 | 详细信息 |
|
下列关于胶体的叙述不正确的是( ) A.用半透膜渗析的方法,可以分离胶体和浊液 B.向氢氧化铁胶体中缓缓滴加稀硫酸,先产生沉淀,进而沉淀溶解 C.“往伤口上撒盐”的做法并无不妥,这是利用了血液中胶体的聚沉 D.水泥厂、面粉厂通常利用胶体电泳进行高压静电除尘 |
|
| 6. 选择题 | 详细信息 |
|
下列反应可用2OH-+CO2=CO32-+H2O表示的是( ) A.向氨水中通入过量CO2 B.向石灰乳中通入过量CO2 C.向氢氧化钠溶液中通入少量CO2 D.向氢氧化钡溶液中通入少量CO2 |
|
| 7. 选择题 | 详细信息 |
|
下列各组离子在给定条件下能大量共存的是( ) A.0.1mol/L NaHCO3溶液中:K+、Ca2+、NO3-、Cl- B.在SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- C.在酸性且为无色透明的溶液中:K+、Ba2+、Fe2+、Br- D.使酚酞变红的溶液中:Mg2+、Cu2+、SO42-、NO3- |
|
| 8. 选择题 | 详细信息 |
|
下列关于化学的文献,理解正确的是( ) A.《咏石灰》中“…烈火焚烧若等闲,…要留清白在人间”,其中“清白”指的是氢氧化钙 B.《肘后备急方》中“青蒿一握,以水二升渍,绞取汁”,该提取过程属于化学变化 C.《抱朴子》中“丹砂(HgS)烧之成水银,积变又还成丹砂”,描述的是升华和凝华过程 D.《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露”,涉及的实验操作是蒸馏 |
|
| 9. 选择题 | 详细信息 |
|
设NA表示阿伏加德罗常数,下列说法正确的是( ) A.将1L0.1mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为0.1NA B.常温常压下,23gNO2和N2O4的混合气体一定含有NA个氧原子 C.1L0.1mol/L Na2SO4溶液中含有0.4NA个氧原子 D.在标准状况下,22.4L的CCl4所含的分子数为NA |
|
| 10. 选择题 | 详细信息 | |||||||||||||||||||||||||
下列按电解质、非电解质、酸性氧化物、碱性氧化物的组合,正确的是( )
|
||||||||||||||||||||||||||
| 11. 选择题 | 详细信息 |
|
下列反应的离子方程式正确的是( ) A.铁粉与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ B.碳酸镁溶于醋酸的反应:MgCO3+2H+=Ca2++CO2↑+H2O C.在澄清石灰水中通入少量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O |
|
| 12. 选择题 | 详细信息 |
通过海水晾晒可以得到粗盐,粗盐除还有NaCl外,还含有MgCl2、 CaCl2、 Na2SO4以及泥沙等杂质。以下是某兴趣小组制备精盐的实验方案,各步操作流程如下。下列说法正确的是 A. 实验过程中①、⑤步骤的操作分别是溶解、过滤 B. 实验过程中步骤④的目的是仅除去溶液中的Ca2+ C. 实验过程中步骤⑦中的蒸发所用到的仪器是酒精灯、玻璃棒、烧杯、铁架台(带铁圈) D. 实验过程中②、④步骤互换,对实验结果不影响 |
|
| 13. 选择题 | 详细信息 |
|
三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是 A. 原子数目相等的三种气体,质量最大的是Z B. 同温同压下,同质量的三种气体,气体密度最小的是X C. 若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol D. 同温下,体积相同的两容器分别充2 g Y气体和1 g Z气体,则其压强比为2︰1 |
|
| 14. 选择题 | 详细信息 |
|
某结晶水合物的化学式为R·nH2O,其相对分子质量为M。25℃时,ag该晶体能够溶于bg水中形成V mL饱和溶液。下列关系中不正确的是( ) A.该溶液的密度为ρ= B.该溶液的物质的量浓度为c= C.该溶液中溶质的质量分数为w= D.25℃时R的溶解度S= |
|
| 15. 选择题 | 详细信息 |
烧杯中盛有100 mL1mol/L的NaHSO4溶液,向其中逐滴滴加1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )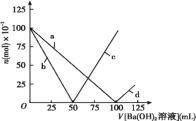 A.曲线d表示Na+的物质的量的变化 B.曲线c表示OH-的物质的量的变化 C.加入Ba(OH)2溶液50 mL反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O D.加入Ba(OH)2溶液大于50mL后,反应的离子方程式为:OH-+H+=H2O |
|
| 16. 选择题 | 详细信息 |
|
已知某固态物质M受热分解的方程式为4M=3X+2NO2+8H2O,冷至室温,得到的混合气相对于氢气的密度为20,则M的相对分子质量为( ) A.344 B.96 C.63 D.86 |
|
| 17. 综合题 | 详细信息 |
|
明胶是水溶性蛋白质混合物,溶于水形成胶体。 (1)明胶溶于水所形成的分散系和K2SO4溶液共同具备的性质是___。 a.都不稳定,密封放置沉淀 b.两者均有丁达尔现象 c.分散质粒子可通过滤纸 (2)现需配制0.50mol·L-1 K2SO4溶液480mL。 ①配制溶液时必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、___、___、以及等质量的几片滤纸。 ②配制该溶液需称取K2SO4晶体的质量为___。 ③下列关于容量瓶的使用方法中,正确的是___。 A.容量瓶可长期存放溶液 B.在容量瓶中直接溶解固体 C.溶液未经冷却即注入容量瓶中 D.向容量瓶中转移溶液要用玻璃棒引流 ④下列操作会使所配溶液浓度偏低的是___。 A.转移溶液时有液体溅出 B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 C.定容时俯视刻度线 D.烧杯和玻璃棒未洗涤 (3)现有下列十种物质:①HCl;②NaHCO3;③K2SO4溶液;④CO2;⑤蔗糖晶体;⑥Ca(OH)2;⑦氢氧化铁胶体;⑧NH3·H2O;⑨空气;⑩Al2(SO4)3 (a)上述物质中属于电解质的有___,非电解质的有___(填序号)。 (b)CO2属于酸性氧化物,SiO2也属于酸性氧化物,请写出SiO2和CaO反应的化学方程式:___。 (c)②在水溶液中的电离方程式为___。 (d)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式:___;如果病人同时患胃溃疡,为防胃壁穿孔,不宜服用小苏打,此时最好用含Al(OH)3的胃药(如胃舒平),它与胃酸反应的离子方程式:___。 (e)若⑦中混有少量的③,提纯的方法是:____。 A.蒸馏(分馏) B.萃取 C.渗析 D.分液 |
|
| 18. 推断题 | 详细信息 | ||||
现有三种可溶性物质A、B、C,其中A、B属于盐,C属于碱,它们溶于水后电离产生的所有离子如下表所示:
|
|||||
| 19. 实验题 | 详细信息 |
某学习小组按如下流程探究碘的制取,甲乙两种制取方案如下: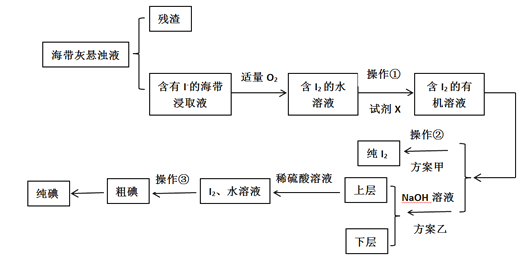 已知:3I2+6OH-=5I-+IO3-+3H2O;5I-+IO3-+6H+=3I2 +3H2O;酸性条件下,I2在水溶液中的溶解度极小。 (1)灼烧海带时,除需要三脚架,泥三角外,还需要用到的实验仪器为___。 A.烧杯 B.表面皿 C.坩埚 D.酒精灯 (2)指出提取碘的过程中有关的实验操作名称:①___;②___;③___。 (3)有机试剂X可以是___(填序号) A.四氯化碳 B.乙醇 C.醋酸 (4)下列关于加入NaOH溶液操作的说法,正确的是___。 A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层 C.主要是除浸取原液中的杂质 D.NaOH溶液可由乙醇代替 (5)方案甲中采用操作②会导致碘的损失,原因是___。 |
|
最近更新



