北京市第四十三中学2020届高三8月摸底考试化学题免费试卷
| 1. 选择题 | 详细信息 |
|
下列氧化还原反应中,氧化剂和还原剂的物质的量之比不是1:2的是 ( ) A. B. C. D. |
|
| 2. 选择题 | 详细信息 |
|
乙酸是一种常见的有机物。下列有关乙酸的化学用语中,不正确的是 A. 实验式:CH2O B. 比例模型: C. 甲基的电子式: |
|
| 3. 选择题 | 详细信息 |
已知有如下三个反应:① A. C. |
|
| 4. 选择题 | 详细信息 |
下列关于自然界中氮循环(如右图)的说法不正确的是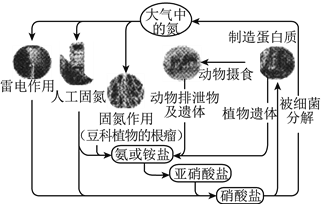 A. 人工固氮可以得到硝酸盐 B. 细菌对氮元素的循环有重要作用 C. 雷电作用可以将氮气直接转化为铵盐 D. 亚硝酸盐转化为硝酸盐的过程中,氮元素被氧化 |
|
| 5. 选择题 | 详细信息 |
|
H-跟NH3的反应为:H-+NH3=NH A.NH3具有还原性 B.H-是很强的还原剂 C.该反应属于置换反应 D.生成标况下2.24LH2时,电子转移0.2NA |
|
| 6. 选择题 | 详细信息 |
|
下列叙述中正确的是 A.0.1 mol Cu和足量的稀硝酸反应时,转移的电子数为0.1×6.02×1023 B.在1L 0.1mol/L的硫酸铁溶液中含有的三价铁离子数为0.2×6.02×1023 C.标准状况下,2.24L溴乙烷中含有的溴离子数目为0.1×6.02×1023 D.4.4g CO2中所含有的原子总数为0.3×6.02×1023 |
|
| 7. 选择题 | 详细信息 |
|
下列说法正确的是 A.标准状况下,11.2 L D2(氘气)中所含中子数为6.02×1023 B.14 g C2H4和C3H6的混合物中,H原子数为2.5×6.02×1023 C.1 L pH=1的 HCl溶液中,HCl分子数为6.02×1022 D.常温常压下,8 g CH4中所含的共用电子对的数目为6.02×1023 |
|
| 8. 选择题 | 详细信息 |
|
常温下,下列各组离子一定可以大量共存的是 A.含NO B.遇石蕊溶液显红色的溶液中: NH C.在与Al反应能放出H2的溶液中: Mg2+、HCO D.在 |
|
| 9. 选择题 | 详细信息 |
|
下列各离子组在指定的溶液中一定能够大量共存的是 A.在无色的溶液中:K+、 Na+、MnO B.在pH=13的溶液中:CO C.水电离出的c(H+)= 10-12 mol·L‾1的溶液中:Cl- 、CH3COO-、NO D.滴加酚酞试液显红色的溶液:Mg2+、NH |
|
| 10. 选择题 | 详细信息 |
|
下列离子方程式正确的是 A.NaHCO3溶液和NaOH溶液混合 HCO B.将少量的二氧化硫气体通入氯化钙溶液中 SO2 + H2O +Ca2+ = CaSO3↓ + 2H+ C.氯化铝溶液中加入过量氨水:Al3+ + 4NH3•H2O = Al O D.铜片与稀HNO3反应:3Cu+2NO |
|
| 11. 选择题 | 详细信息 |
|
下列离子反应方程式书写正确的是 A.向稀硝酸中加入过量铁粉Fe+4H++NO B.用热的纯碱溶液能清洗油污:CO C.少量碳酸氢钠溶液中加入过量石灰水2HCO D.硫化钠溶液显碱性 S2-+H2O |
|
| 12. 选择题 | 详细信息 |
|
某温度下,将Cl2通入氢氧化钾溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量之比是1∶2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 A. 2∶3 B. 4∶3 C. 10∶3 D. 11∶3 |
|
| 13. 选择题 | 详细信息 | ||||||||
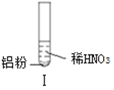
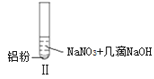
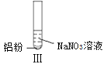
某同学做如下实验
下列说法不正确的是( ) |
|||||||||
| 14. 选择题 | 详细信息 | |||||||||||||||
下表中“试剂”与“操作及现象”对应关系错误的是
|
||||||||||||||||
| 15. 实验题 | 详细信息 |
某同学取海带灰加蒸馏水煮沸2~3 min,冷却,过滤,获得含I−的溶液,并设计以下实验方案,从中提取I2。 已知:3I2 + 6NaOH == 5NaI + NaIO3 + 3H2O (1)试剂a的作用是________。 (2)试剂b应选择________(填序号)。 A.CCl4 B.苯 C.酒精 D.植物油 (3)操作1的名称是________。 (4)反应3的离子方程式是________。 |
|
| 16. 填空题 | 详细信息 |
|
向盛有KI溶液的试管中,加入少许CCl4后,滴加氯水,CCl4层变为紫色,如果继续滴加氯水,发现CCl4层颜色变浅,最后变为无色。完成下列填空: (1)整个过程中,充当氧化剂的物质是__________,使CCl4层变为紫色时,水溶液中发生反应的离子方程式为___________。 (2)写出并配平CCl4层由紫色变为无色过程中的化学方程式(如果计量数为1,可以补填写)__________ (3)把KI溶液换成KBr溶液,CCl4层变为_______色;继续滴加氯水,CCl4层颜色没有变化。则Cl2、HIO3、HBrO3氧化性强弱顺序为______。 |
|
| 17. 填空题 | 详细信息 |
|
C、Si是构成无机非金属材料的重要元素。 (1)Si在周期表中的位置为_____________。 (2)为比较C、Si的非金属性,某同学设计了如下实验:  装置①中盛放的试剂是________,装置②中发生反应的离子方程式是_____________。 (3)SiC是一种重要的高温耐磨材料。SiC中,C元素显________(填“正”或“负”)化合价,从原子结构角度解释原因是__________________。 |
|
| 18. | 详细信息 |
|
NH3是一种重要的化工产品,是制造铵盐的原料。 (1) NH3的电子式为____________ 。 (2)实验室用图1所示装置制备氨气,该反应的化学反应方程式为_______,检验氨气的方法是____________。  (3)实验室也常用图2所示的简易装置制备氨气,下列说法正确的是________(填字母序号)。 a.锥形瓶中加入的固体物质可以是碱石灰 b.制得的氨气可用碱石灰来干燥 c.可用图3装置和试剂对氨气进行尾气处理 (4)氯化铵常用作除锈剂,用化学用语表达其水溶液呈酸性的原因是______; (5)工业上用活性炭做催化剂,在280~450℃条件下氯化铵与甲醇反应制取一氯甲烷,该反应的化学方程式为________。 |
|
| 19. | 详细信息 | ||||
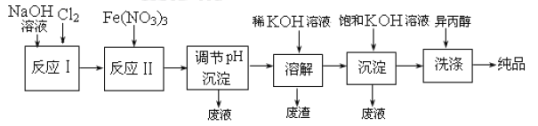
高铁酸盐(含有FeO
|
|||||
| 20. 填空题 | 详细信息 |
|
SO2和NOx都是大气污染物。 (1)空气中的NO2可形成硝酸型酸雨,该反应的化学方程式是____。 (2)汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是_________。 (3)利用氨水可以将SO2和NO2吸收,原理如下图所示:  NO2被吸收的离子方程式是_______。 |
|
| 21. | 详细信息 |
中药秦皮中含有的七叶内酯属于香豆素类,具有显著的消炎作用,是抗痢疾杆菌的有效成分。其结构简式如图: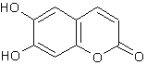 (1)七叶内酯的含氧官能团的名称为___________。 (2)七叶内酯可以发生的反应类型有__________(填序号)。 a.加成反应 b.取代反应 c.消去反应 (3)在合成七叶内酯时,肉桂醇可为原料之一  A的结构简式为_______。 (4)七叶内酯与足量氢氧化钠稀溶液充分反应。化学方程式为______。 |
|
最近更新