江苏2019年九年级化学后半期中考真题免费检测试卷
| 1. | 详细信息 |
|
2019年5月11日,扬州市启动了城市节水宣传活动。H2O属于( ) A. 单质 B. 氧化物 C. 混合物 D. 有机物 |
|
| 2. | 详细信息 |
|
6月5日为世界环境日。下列行为有利于保护环境的是( ) A. 绿色低碳出行 B. 大量使用农药 C. 露天焚烧垃圾 D. 乱扔废旧电池 |
|
| 3. | 详细信息 |
|
下列过程涉及化学变化的是( ) A. 干冰升华 B. 氧气液化 C. 氢气燃烧 D. 矿石粉碎 |
|
| 4. | 详细信息 |
|
下列物质的俗名与化学式对应关系正确的是( ) A. 干冰:O2 B. 纯碱:CaCO3 C. 食盐:NaCl D. 烧碱:Na2SO4 |
|
| 5. | 详细信息 |
|
下列金属中,金属活动性最强的是( ) A. 钾 B. 铁 C. 铜 D. 金 |
|
| 6. | 详细信息 |
|
下列物质由分子构成的是( ) A. 金刚石 B. 铁 C. 氯化钠 D. 氧气 |
|
| 7. | 详细信息 |
|
下列溶液显碱性的是( ) A. 酸雨 B. 食醋 C. NaOH溶液 D. 盐酸 |
|
| 8. | 详细信息 |
|
水是人类不可缺少的宝贵资源。我国的“节水标志”是( ) A.  B. B.  C. C.  D. D.  |
|
| 9. | 详细信息 |
|
下列物质能为人们生命活动提供所需能量的是( ) A. N2 B. CO2 C. 淀粉 D. 氯化钠 |
|
| 10. | 详细信息 |
|
配制50g溶质质量分数为15%的氯化钠溶液,不需要用到的仪器是( ) A. 集气瓶 B. 烧杯 C. 玻璃棒 D. 量筒 |
|
| 11. | 详细信息 |
|
2KI+H2SO4+O3═O2+M+K2SO4+H2O中M的化学式是( ) A. H2 B. KOH C. HI D. I2 |
|
| 12. | 详细信息 |
|
下列属于复合肥的是( ) A. NH4NO3 B. KNO3 C. K2SO4 D. NaNO3 |
|
| 13. | 详细信息 |
|
下列反应属于分解反应的是( ) A. 2H2+O2 B. Zn+H2SO4=ZnSO4+H2↑ C. 2KClO3 D. KOH+HCl=KCl+H2O |
|
| 14. | 详细信息 |
|
维生素D2的化学式为C28H44O,下列关于维生素D2的说法正确的是( ) A. 碳元素的质量分数最大 B. 含有3个原子 C. 相对分子质量是73g D. H、O元素质量比为44:1 |
|
| 15. | 详细信息 |
|
下列实验方案能达到目的是( ) A. 用稀盐酸和BaCl2溶液检验Na2SO4溶液中是否含有H2SO4 B. 用肥皂水鉴别蒸馏水与CaCl2溶液 C. 用足量NaOH溶液除去CO2气体中的少量HCl D. 用澄清石灰水检验Na2CO3溶液中是否含有K2CO3 |
|
| 16. | 详细信息 |
|
实验室用KClO3和MnO2制O2,反应后分离KCl和MnO2(难溶于水)。下列图示装置能达到实验目的是( ) A.  用此装置制取O2 B. 用此装置制取O2 B. C.  用此装置过滤 D. 用此装置过滤 D. 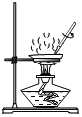 用此装置蒸发滤液 用此装置蒸发滤液 |
|
| 17. | 详细信息 |
|
下列有关物质性质与用途对应关系正确的是( ) A. CO2能与水反应,可用于灭火 B. 铜有金属光泽,可用于制造电线 C. 常温下N2很稳定,可用作粮食保护气 D. 石墨具有导电性,可用于生产铅笔芯 |
|
| 18. | 详细信息 |
某反应前后分子变化的微观示意图如图。下列说法正确的是( )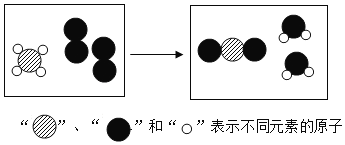 A. 反应物中没有单质 B. 图中共表示3种物质 C. 反应后元素种类增多 D. 反应前后原子个数不变 |
|
| 19. | 详细信息 |
|
1800年,人类电解水获得成功。某同学利用如图所示装置进行该实验时,发现左、右两侧试管内气体体积比略大于2:1.下列说法错误的是( ) 已知:①相同条件下,气体的体积比等于气体的分子个数比; ②常温常压时,1L水可溶解0.031L O2、0.57L O3。 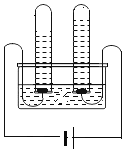 A. 水在通电时能发生化合反应 B. 实验中若加入少量NaOH溶液,则导电性增强 C. 从实验结果可以确定,相同条件下,H2在水中的溶解度比O2的小 D. 若右侧试管内产生少量O3,也会使左右两侧试管内气体体积比略大于2:1 |
|
| 20. | 详细信息 |
工业上,利用溶液X(溶质为CuCl2和HCl)在50℃时与Cu反应制作电路。CuCl2消耗后,HCuCl2经处理又能转化为CuCl2,流程如图。下列说法错误的是( ) 已知:①反应I CuCl2+Cu+2HCl=2HCuCl2 ②反应Ⅱ2HCuC12+H2O2=2CuCl2+2H2O A. 反应I和Ⅱ涉及的元素中仅Cu、O元素的化合价发生了变化 B. 反应Ⅱ中生成的CuCl2质量与溶液X中CuCl2质量一定相同 C. 工业上,每溶解6.4kg Cu时,外界只需提供34kg 10%的双氧水就能使生成的 HCuCl2全部转化为CuCl2 D. 若由Cu、CuCl、CuCl2中的若干种组成的10.66g混合物中,铜元素为6.4g,则该混合物中一定含CuCl2 |
|
| 21. | 详细信息 | |||||||||
由氯化钡废液(杂质为FeCl3及微量NaCl)制备产品BaC12•2H2O的流程如图。 (1)氯化钡废液属于_____(填“纯净物”或“混合物”)。FeCl3中铁元素的化合价是_____。 (2)煅烧石灰石制取生石灰的化学方程式为_____,生石灰变成熟石灰的过程是_____过程(填“吸热”或“放热”),石灰水能使紫色石蕊试液变_____色。石灰石和熟石灰中常用于改良酸性土壤的是_____。 (3)用95%乙醇(C2H6O)洗涤滤渣可除微量NaCl.C2H6O由_____种元素组成,是_____化合物(填“有机”或“无机”)。C2H6O在O2中完全燃烧生成CO2和_____。2个CO2分子可用化学符号表示为_____。煤、氢气、乙醇三种燃料中,最清洁的是_____。 (4)结合流程和表回答:工业上选择25℃而不选择5℃进行冷却结晶的主要原因是①滤液多次循环后,25℃与5℃结晶产品的总产率基本相同;②_____。 表:每次结晶时,温度对产品纯度和产率的影响
|
||||||||||
| 22. | 详细信息 | ||||||||||
|
日常生活、社会发展都与化学密切相关。 (1)3D打印机根据不同需求,使用不同材料,如铝合金、聚乙烯、碳纤维增强复合材料。其中属于金属材料的是_____,属于合成材料的是_____,属于复合材料的是_____。  (2)《本草纲目》记载,杨桃具有去风热、生津止渴等功效。 ①杨桃的主要成分是水,还含有糖类和蛋白质等。葡萄糖和蛋白质中属于有机高分子化合物的是_____,能在人体内分解生成氨基酸的是_____。葡萄糖由_____三种元素组成。 ②经测定酸杨桃的pH为1.35,甜杨桃的pH为1.81,其中酸性较强的是_____。(填“酸杨桃”或“甜杨桃”) ③酸杨桃中矿质元素含量如表2.人体缺少_____元素易得佝偻病,缺少_____元素易得贫血症。如表所列元素中,属于微量元素的是_____、_____。 表:每克酸杨桃中矿质元素的含量
|
|||||||||||
| 23. | 详细信息 |
|
MgO在医药建筑等行业应用广泛。硫酸镁和木炭高温煅烧的产物为MgO(固体)、SO2、CO2、CO、硫蒸气。 (1)工业上,SO2的任意排放会引起的环境问题是_____。化石燃料燃烧是产生SO2的主要原因,下列做法能减少SO2排放的是_____ (填字母)。 a开发新能源替代化石燃料 b向高空排放SO2 (2)在高温、催化剂条件下,CO和H2可化合成燃料甲醇(CH3OH),该反应中CO和H2的分子个数比为_____。若CO和H2中混有H2S气体,H2S会与催化剂中的Cu在高温下发生置换反应,其中一种产物为CuS,该反应的化学方程式为_____。 (3)利用如图装置对硫酸镁和木炭进行高温煅烧,并对产生的四种气体进行分步吸收或收集。 已知:常温下,硫为固体;SO2、CO2均能与NaOH溶液反应。  ①装置B、C中的溶液分别是_____、_____。(填字母) a NaOH溶液 b KMnO4溶液 ②装置B、C的作用分别是_____、_____。 ③装置D的作用是_____。 ④若将装置A中的固体隔绝空气加热至500℃,就会变成蒸气,其中有一种相对分子质量为128的气体。该气体的化学式为_____。 |
|
| 24. | 详细信息 |
以MnO2为原料制备MnSO4•H2O的工业流程如图。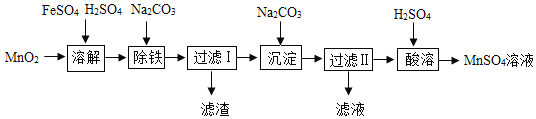 已知:①沉淀时的化学方程式为7MnSO4+7Na2CO3+11H2O=MnCO3•6Mn(OH)2•5H2O↓+7Na2SO4+6CO2↑ ②MnSO4•H2O和MnSO4•5H2O易溶于水,难溶于乙醇。 ③MnSO4的溶解度曲线如图1所示。 (1)溶解时,为控制80℃,在实验室可用水浴加热如图2.水浴加热需要的玻璃仪器有酒精灯、_____、_____。水浴加热的优点有_____。能加快溶解的方法有_____(写一种)。  (2)除铁时需要搅拌,搅拌的作用是_____。 (3)过滤I所得滤液的溶质主要是Na2SO4和_____。过滤时,玻璃棒的作用是_____。 (4)酸溶时,MnCO3•6Mn(OH)2•5H2O与足量稀硫酸反应的化学方程式为_____。 (5)请补充完整由流程中“酸溶”所得MnSO4溶液制备MnSO4•H2O的实验方案:将MnSO4溶液转移至蒸发皿中,_____,在高于40℃时趁热过滤,_____,100℃烘干得MnSO4•H2O。 |
|
| 25. | 详细信息 |
|
实验室以某石灰石(含少量Fe2O3)为原料制备高纯CaCO3的步骤如下。 溶解:向石灰石样品中加入适量盐酸,至反应完全。 除铁:加入氨水调节pH,然后加入适量Ca(OH)2,充分反应后过滤。 沉淀:向滤液中补充氨水,通入CO2,反应一段时间。 分离:过滤、洗涤、干燥得高纯CaCO3。 (1)溶解时,CaCO3、Fe2O3分别与盐酸反应的化学方程式为_____、_____。判断样品已完全反应的实验现象是_____。 (2)除铁时,选用Ca(OH)2而不选用NaOH,其主要原因是Ca(OH)2价格低且来源广、_____、_____;过滤所得滤渣的主要成分为_____。 (3)沉淀时,其他条件相同,反应温度对CaCO3产率的影响如图。高于35℃时,CaCO3产率下降的主要原因是_____、_____。(已知: (4)分离时,若向过滤所得滤液中加入_____ (填化学式)并加热,则可回收NH3。 (5)该实验中可以循环利用的物质有H2O和_____。 (6)石灰厂煅烧石灰石生产CaO,若要得到28t CaO,则至少需要含CaCO3 90%的石灰石____吨。(写出计算过程,保留一位小数。) 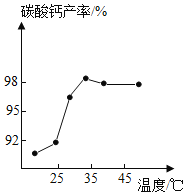 |
|
最近更新



