全国2020年高三化学下学期专题练习试卷完整版
| 1. 选择题 | 详细信息 |
|
A.25% B.75% C.88% D.32% |
|
| 2. 选择题 | 详细信息 |
A,B,C,D四种物质之间的转化关系如图所示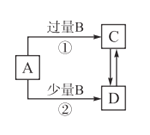 A.若A为 B.若A为Fe,B可能为稀硝酸,反应 C.若A为NaOH溶液,B可能为 D.若A为 |
|
| 3. 选择题 | 详细信息 | |||||||||||||||
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,下表为四种金属的熔、沸点:
|
||||||||||||||||
| 4. 选择题 | 详细信息 |
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )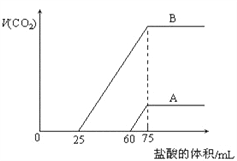 A. A曲线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是Na2CO3和NaHCO3 B. B曲线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:OH-+H+=H2O H++CO32-=HCO3- C. B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为224mL D. 原NaOH溶液的物质的量浓度为1.0mol/L |
|
| 5. 选择题 | 详细信息 |
|
下列物质的转化在给定条件下能实现的是( ) A. NaCl(aq) B. CuCl2 C. Al D. MgO(s) |
|
| 6. 选择题 | 详细信息 | |||||||||||||||||||||||||
下表各组物质中,不可以实现x
|
||||||||||||||||||||||||||
| 7. 选择题 | 详细信息 |
|
下列叙述正确的是 ①锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率 ②镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀 ③电镀时,应把镀件置于电解槽的阴极 ④冶炼铝时,用电解熔融氧化铝的方法 ⑤钢铁表面常易锈蚀生成Fe2O3•nH2O A.①②③④⑤ B.①③④⑤ C.①③⑤ D.②④ |
|
| 8. 选择题 | 详细信息 |
|
下列说法中正确的是 A.实验室用加热NH4Cl固体的方法制备NH3 B.用点燃的火柴在液化气钢瓶口检验是否漏气 C.工业上用SO2漂白纸浆、毛、丝、草帽辫等 D.保存金属钠的仓库着火可以用二氧化碳灭火器去灭火 |
|
| 9. 选择题 | 详细信息 |
|
下列物质与其用途完全符合的有多少条( ) A.6 B.7 C.5 D.4 |
|
| 10. 选择题 | 详细信息 |
下列反应中不符合右图所示能量变化的是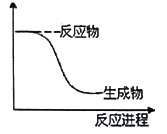 A. 电解水 B. A1 与 Fe2O3 反应 C. Na与水反应 D. NaOH溶液与稀盐酸反应 |
|
| 11. 选择题 | 详细信息 |
|
下列试剂的保存或使用正确的是( ) A. 金属锂保存在煤油中,使用前要用滤纸吸干煤油 B. 过氧化钠比氧化钠稳定,因此过氧化钠可露置在空气中 C. 称量NaOH固体时,应先在天平两个托盘上各放一张等质量的纸,左边纸上放NaOH,右边纸上放砝码 D. 做焰色反应实验时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检验物中一定有钾元素 |
|
| 12. 选择题 | 详细信息 |
|
下列操作中,溶液的颜色不发生变化的是( ) A.碳酸氢钠溶液中滴加稀盐酸 B.硫酸铁溶液中滴加硫氰化钾溶液 C.氯化亚铁溶液中滴加氯水 D.三氯化铁溶液中加入过量Cu粉 |
|
| 13. 选择题 | 详细信息 |
|
认识反应条件对化学反应的影响,对学好化学具有重要意义。下列说法中正确的是 A. 镁在空气中或纯净氧气中燃烧的产物都只有MgO B. 钠在敞口容器中存放或在空气中燃烧的产物都是Na2O2 C. 将四氧化三铁溶解于过量的硝酸中,所得溶液中含有Fe3+、Fe2+ D. 氯化铝和过量的氨水反应一定得到Al(OH)3沉淀 |
|
| 14. 选择题 | 详细信息 |
|
以下物质间的每步转化通过一步反应能实现的是( ) A. Al-Al2O3-Al(OH)3-NaAlO2 B. N2-NH3-NO2-HNO3 C. Cu-CuO-Cu(OH)2-CuSO4 D. Na-Na2O2-Na2CO3-NaOH |
|
| 15. 选择题 | 详细信息 |
|
自然界中只有极少数金属(如金和铂等)能以单质形式存在。它们应具备的性质是 A.不易被氧化 B.还原性较强 C.可与强酸反应放出氢气 D.可与空气中的氧气反应形成保护膜 |
|
| 16. 选择题 | 详细信息 |
|
对氧化铝的分类中正确的是 A.酸性氧化物 B.碱性氧化物 C.两性氧化物 D.不成盐氧化物(像CO一样) |
|
| 17. 选择题 | 详细信息 |
|
把含有氧化铁的铁片投入到足量的稀盐酸中,直到铁片完全溶解,经分析该溶液中无 A.1:1 B.2:5 C.4:1 D.3:1 |
|
| 18. 选择题 | 详细信息 |
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入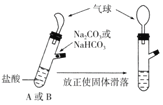 A.B装置的气球膨胀的体积大 B.最终两试管中NaCl的物质的量一定相同 C.若最终两气球体积不同,则盐酸的浓度一定小于或等于 D.若最终两气球体积相同,则盐酸的浓度一定大于或等于 |
|
| 19. 选择题 | 详细信息 |
|
将Na2O2投入FeCl2溶液中,可观察到的现象是 A.生成白色沉淀 B.生成红褐色沉淀 C.无气泡产生 D.无变化 |
|
| 20. 推断题 | 详细信息 |
X、Y、Z是中学化学常见的三种物质,它们之间的相互转化关系如下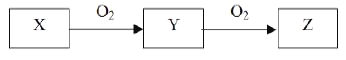 I.若Y是一种易溶于水,且能使品红溶液褪色的无色刺激性气味的气体。 (1)则Y和新制氯水主要成分反应生成两种强酸的化学方程式______________。 (2) Y气体的大量排放会形成酸雨,在工业上可以用足量氨水吸收,化学方程式为________________。 (3)Z的水溶液可以制得某种强酸E。实验室用 ①制该稀E溶液需要使用的玻璃仪器有胶头滴管、量筒、烧杯、____和_____; ②算所需E浓溶液的体积为___mL(保留1位小数)。 II.若Z是淡黄色固体粉末。在呼吸面具或潜水艇中由Z和CO2制备氧气的化学反应方程式为____。 III.若Z是红棕色气体。 (1)试写出Z与水反应制备另一种强酸F的化学方程式_______。 (2)2.0g铜镁合金完全溶解于 |
|
| 21. 综合题 | 详细信息 |
|
铁及其化合物在日常生活中有广泛的应用,回答下列问题。 (1)用K2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是____________(用离子方程式表示);但Fe3+净水要腐蚀设备,在腐蚀钢铁设备时,除H+作用外,另一主要原因是________________________________。 (2)钢铁腐蚀造成很大损失,用如图装置防止钢铁腐蚀(烧杯中均为食盐水),X极的电极材料应是________________(填字母)。  A、锌 B、铜 C、银 D、石墨 (3)高铁电池是一种新型的二次电池,电解液为碱性溶液,其反应式如下: 3Zn + 2K2FeO4 + 8H2O ①写出该电池放电时的正极反应式______________________________。 ②如图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有______。  (4)从保护环境的角度考虑,制备K2FeO4较好的方法为电解法,其装置如图所示。  ①石墨做电解池的______极(填“阴”或“阳”),溶液中OH-向_____移动(填“铁丝网”或“石墨”) ②电解过程中阳极的电极反应式为______________________________。 ③若维持电流强度为6A,电解5小时,理论上可制得K2FeO4的质量为_________g(已知F=96500 C/mol,结果保留1位小数) (5)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5 mol/L 500 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入____mL 2 mol/L的盐酸(滴加盐酸前后,溶液总体积不变)。 |
|
| 22. 推断题 | 详细信息 | ||||||||||||
T、W、X、Y、Z为前四周期元素,其原子序数依次增大,有关五种元素的性质或原子结构描述如下:
|
|||||||||||||
| 23. 综合题 | 详细信息 |
近年科学家提出“绿色自由”构想。把含有大量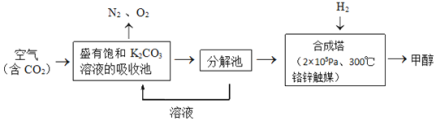 (1)分解池中主要物质是______; (2)在合成塔中,若有 (3)该工艺在那些方面体现了“绿色自由”构想中的“绿色”______。(答二条) (4)一定条件下,向2L恒容密闭容器中充入1mol 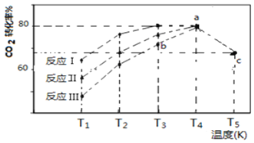 ①催化剂效果最佳的反应是______ (填“反应I”,“反应II”,“反应III”)。 ②b点v (正)______ v (逆)(填“>”,“<”,“=”)。 ③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是______。 ④c点时该反应的平衡常数K=______。 ⑤一定条件下,向2L恒容密闭的上述容器中再充入1mol (5)科学家还研究了其它转化温室气体的方法,利用图所示装置可以将  |
|
高中化学 试卷推荐
最近更新



