2016-2017年高二上半年化学期中考试考卷带参考答案和解析(广东省揭阳市揭西县河婆中学)
| 1. | 详细信息 |
|
下列反应既属于氧化还原反应,又是吸热反应的是( ) A.铝片与稀盐酸的反应 B.Ba(OH)2?8H2O与NH4Cl的反应 C.灼热的炭与CO2的反应 D.甲烷在氧气中的燃烧反应 |
|
| 2. | 详细信息 |
|
化学与生产、生活密切相关.下列叙述正确的是( ) A.BaSO4在医学上用作钡餐,Ba2+对人体无毒 B.葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 C. D.煤的干馏和石油的分馏均属化学变化 |
|
| 3. | 详细信息 |
|
用NA表示阿伏伽德罗常数的值.下列叙述正确的是( ) A.常温常压下,16g CH4含有CH4分子数为NA B.常温常压下,22.4L CO2含有CO2分子数为NA C.1mol Na燃烧生成Na2O2失去的电子数为2NA D.0.5mol?L?1的CuCl2溶液中含Cl?数为NA |
|
| 4. | 详细信息 |
|
在2A+B?3C+4D反应中,表示该化学反应速率最快的是( ) A.v(A)=0.5mol/(L?s) B.v(B)=0.3mol/(L?s) C.v(C)=0.8mol/(L?s) D.v(D)=1mol/(L?s) |
|
| 5. | 详细信息 |
X、Y、Z、W 是短周期元素,其在周期表的位置如图,请找出错误选项( )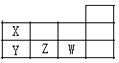 A.原子半径:Y>Z>W B.酸性:HWO4>HXO3>H3YO4 C.热稳定性:HW>XH3>YH3 D.离子半径:Y3?<Z2?<W? |
|
| 6. | 详细信息 |
|
在密闭容器中A与B反应生成C,其反应速率分别用v(A),v(B),v(C)表示,已知v(A),v(B),v(C)之间有以下关系3v(A)=2v(B),3v(C)=2v(B),则此反应可表示为( ) A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C |
|
| 7. | 详细信息 |
|
下列化学反应的离子方程式正确的是( ) A.用小苏打治疗胃酸过多:HCO3?+H+?CO2↑+H2O B.往碳酸镁中滴加稀盐酸:CO32?+2H+?CO2↑+H2O C.往氨水中滴加氯化铝溶液:Al3++4OHAlO2?+2H2O D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42?+H++OHBaSO4↓+H2O |
|
| 8. | 详细信息 |
|
根据以下3个热化学方程式:2H2S(g)+3O2(g)→2SO2(g)+2H2O(l)+Q1kJ;2H2S(g)+O2(g)→2S(s)+2H2O(l)+Q2kJ;2H2S(g)+O2(g)→2S(s)+2H2O(g)+Q3kJ.判断Q1、Q2、Q3三者关系正确的是( ) A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3 |
|
| 9. | 详细信息 |
|
已知反应A2(g)+2B2(g)?2AB2(g)△H<0,下列说法正确的是( ) A.升高温度,正向反应速率增加,逆向反应速率减小 B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
|
| 10. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||
现有反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的 ( )
|
|||||||||||||||||||||||||||||||||||||||||
| 11. | 详细信息 |
|
人造地球卫星用到的一种高能电池银锌蓄电池,其电池的电极反应式为:Zn+2OH2eZnO+H2↑,Ag2O+H2O+2e2Ag+2OH? . 据此判断氧化银是( ) A.负极,被氧化 B.正极,被还原 C.负极,被还原 D.正极,被氧化 |
|
| 12. | 详细信息 |
|
对于可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( ) A.达到化学平衡时,4υ正(O2)=5υ逆(NO) B.若单位时间内生成xmolNO的同时,消耗xmolNH3 , 则反应达到平衡状态 C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 D.化学反应速率关系是:2υ正(NH3)=3υ正(H2O) |
|
| 13. | 详细信息 |
|
实验室制Cl2的反应为4HCl(浓)+MnO2 A.还原剂是HCl,氧化剂是MnO2 B.每消耗1 mol HCl,转移电子的物质的量为2 mol C.每生成1 mol Cl2 , 转移电子的物质的量为2 mol D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
|
| 14. | 详细信息 |
已知某可逆反应m A(g)+n B(g)?p C(g)△H,在密闭容器中进行,如图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )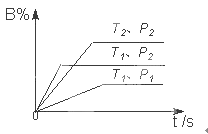 A.T1<T2 , P1>P2 , m+n>p,△H<0 B.T1>T2 , P1<P2 , m+n>p,△H>0 C.T1<T2 , P1>P2 , m+n<p,△H<0 D.T1>T2 , P1<P2 , m+n<p,△H>0 |
|
| 15. | 详细信息 |
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.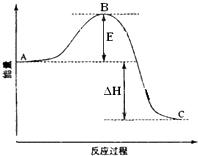 已知1mol SO2(g)氧化为1mol SO3(g)的△H=?99kJ?mol?1 . 请回答下列问题: (1)图中A、C分别表示 (2)E的大小对该反应的反应热有无影响? . 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? , 理由是 (3)图中△H= KJ?mol?1 . |
|
| 16. | 详细信息 |
为了验证木炭可被浓H2SO4氧化成CO2 , 选用下图所示仪器(内含物质)组装成实验装置: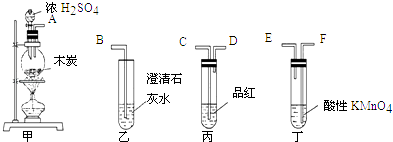 (1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母): 接 , 接 , 接 ; (2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中 ;丙中 (3)丁中酸性KMnO4溶液的作用是 ; (4)写出甲中反应的化学方程式 . |
|
| 17. | 详细信息 |
已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料. (1)A的电子式为 , F的结构简式 . (2)D分子中的官能团名称是 , 请设计一种实验来验证D物质存在该官能团的方法是 (3)写出下列反应的化学方程式并指出反应类型:③ , 反应类型 . |
|
| 18. | 详细信息 |
|
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量. (1)写出该反应的热化学方程式 . (2)已知H2O(l)?H2O(g);△H=+44kJ?mol?1 , 则16g液态肼燃烧生成氮气和液态水时,放出的热量是 kJ. (3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是 . (4)已知N2(g)+2O2(g)?2NO2(g);△H=+67.7kJ?mol?1 , N2H4(g)+O2(g)?N2(g)+2H2O (g);△H=?534kJ?mol?1 , 根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式 . |
|
| 19. | 详细信息 | ||||||||||||
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
回答下列问题: |
|||||||||||||
最近更新



