2018-2019年高二第二学期教学质量调研化学考题(江苏省如皋中学)
| 1. 选择题 | 详细信息 |
|
突破纯碱制造技术,发明连续生产纯碱与氯化铵的联合制碱新工艺的中国化学家是 A. 钱学森 B. 侯德榜 C. 屠呦呦 D. 袁隆平 |
|
| 2. 选择题 | 详细信息 |
|
下列过程只涉及物理变化的是 A. 冰雪消融 B. 百炼成钢 C. 火烧连营 D. 蜡炬成灰 |
|
| 3. 选择题 | 详细信息 |
|
中子数为8的碳原子可用于考古,其核素组成的符号可表示为 A. 86C B. 68C C. 146C D. 148C |
|
| 4. 选择题 | 详细信息 |
|
实验室制备硅酸的反应为Na2SiO3+2HCl=2NaCl+H2SiO3↓,该反应属于 A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应 |
|
| 5. 选择题 | 详细信息 |
|
下列化学用语正确的是 A. 甲烷的结构式:CH4 B. 氧原子的结构示意图: C. N2分子的电子式: D. Ba(OH)2的电离方程式:Ba(OH)2=Ba2++(OH)22- |
|
| 6. 选择题 | 详细信息 |
下列气体既能用下图所示方法收集,也能用排水法收集的是 A. H2 B. O2 C. NH3 D. SO2 |
|
| 7. 选择题 | 详细信息 |
|
下列物质属于共价化合物的是 A. CaO B. NaOH C. K2O D. CO2 |
|
| 8. 选择题 | 详细信息 |
|
关于工业合成氨反应:N2+3H2 A. 使用合适的催化剂可以加快反应速率 B. 升高温度会降低反应速率 C. 控制条件可以将N2和H2完全转化为NH3 D. H2浓度不变,只增大N2浓度不能增大反应速率 |
|
| 9. 选择题 | 详细信息 |
|
下列物质的俗名与化学式对应正确的是 A. 苏打——NaHCO3 B. 明矾——Al2(SO4)3 C. 干冰——CO2 D. 生石灰——Ca(OH)2 |
|
| 10. 选择题 | 详细信息 |
|
在含有大量Ba2+、OH-、Cl-的溶液中,还可能大量共存的离子是 A. CO32- B. NO3- C. H+ D. Fe3+ |
|
| 11. 选择题 | 详细信息 |
|
FeSO4是补血剂的成分之一。FeSO4属于 A. 酸 B. 碱 C. 盐 D. 氧化物 |
|
| 12. 选择题 | 详细信息 |
|
下列有关说法正确的是 A. 二氧化硅可用于制造光导纤维 B. 氯气能使干燥有色布条褪色 C. 铝制容器可长期存放酸性食物 D. 浓硫酸常温下不与铁片反应 |
|
| 13. 选择题 | 详细信息 |
|
实验室用于分离碘的四氯化碳溶液和水的实验装置是 A.  B. B.  C.  D. D.  |
|
| 14. 选择题 | 详细信息 |
|
下列有关苯、乙酸、乙醇的说法正确的是 A. 都易溶于水 B. 苯易与液溴发生加成反应 C. 乙醇不能与金属钠反应 D. 乙酸与乙醇一定条件下可反应生成乙酸乙酯 |
|
| 15. 选择题 | 详细信息 |
|
在汽车尾气处理装置中发生如下反应:4CO+2NO2 A. NO2是还原剂 B. CO被氧化 C. NO2发生氧化反应 D. CO得到电子 |
|
| 16. 选择题 | 详细信息 |
|
下列说法正确的是 A. 0.1 mol H2中含有的分子数为6.02×1022 B. 24 g Mg变成Mg2+时失去的电子数为6.02×1023 C. 1 L 1 mol·L-1 CaCl2溶液中含有的Cl-数为6.02×1023 D. 常温常压下,11.2 L O2中含有的原子数为6.02×1023 |
|
| 17. 选择题 | 详细信息 |
|
下列反应的离子方程式书写正确的是 A. 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ B. 溴化钠溶液与氯气反应:2Br-+Cl2=2Cl-+Br2 C. 氢氧化铜与稀硫酸反应:OH-+H+=H2O D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
|
| 18. 选择题 | 详细信息 |
|
下列过程放出热量的是 A. 断裂化学键 B. 水的分解 C. 总能量生成物高于反应物的反应 D. 浓硫酸稀释 |
|
| 19. 选择题 | 详细信息 |
|
下列方案能达到实验目的的是 A. 用碱石灰干燥Cl2 B. 用饱和Na2CO3溶液除去CO2中的HCl C. 用品红溶液鉴别SO2和CO2 D. 用焰色反应鉴别KCl和KOH |
|
| 20. 选择题 | 详细信息 |
某兴趣小组设计的简易原电池装置如下图所示。该电池工作时,下列说法正确的是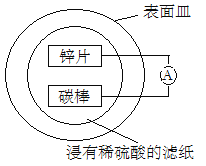 A. 锌片做正极 B. 碳棒上有气泡产生 C. 可将电能转化为化学能 D. 电子由碳棒经导线流向锌片 |
|
| 21. 选择题 | 详细信息 |
|
下列物质转化常通过加成反应实现的是 A. CH2=CH2 CH3CH2Br B. CH3CH2OH CH3CHO C. CH4CH3Cl D. |
|
| 22. 选择题 | 详细信息 |
|
X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且X与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5∶4。下列说法正确的是 A. 原子半径:r(W)>r(Z)>r(Y)>r(X) B. Y的简单气态氢化物的热稳定性比Z的强 C. 由Z、W组成的化合物只有一种 D. 由X、Y、Z三种元素组成的化合物可以是酸、碱或盐 |
|
| 23. 选择题 | 详细信息 |
|
实验室有一包白色固体,可能含有NaCl、NaHCO3和NH4Cl中的一种或多种。下列根据实验事实得出的结论正确的是 A. 取一定量固体,在空气中充分加热,有白色物质残留,则原白色固体中含NaCl B. 取一定量固体,加水溶解,向溶液中加入少量NaOH溶液,再滴加AgNO3溶液,有白色沉淀生成,则该白色沉淀是AgCl C. 取一定量固体,加水溶解,向溶液中滴加足量NaOH溶液,加热,将得到气体直接通入足量浓硫酸,浓硫酸增重3.40 g,则原白色固体中含NH4Cl 10.7 g D. 取一定量固体,加水溶解,向溶液中滴加足量Ba(OH)2溶液,有白色沉淀生成,将沉淀过滤、洗涤、干燥,得到沉淀质量为3.94 g,则原白色固体中含NaHCO3 1.68 g |
|
| 24. 填空题 | 详细信息 |
|
(1)三月万物复苏,很多人会外出踏青旅游。 ①自驾游出行方便。制造汽车轮胎的主要材料是____(填字母)。 a.铝合金 b.橡胶 c.玻璃 ②高速列车出行快捷。建设铁路需要大量水泥。工业上生产水泥的主要原料是石灰石和____(填字母)。 a.黏土 b.纯碱 c.石英 ③轮船出行舒适。为防止轮船钢板被腐蚀,可在钢板上镶嵌____(填字母)。 a.铜块 b.锡块 c.锌块 (2)旅游期间,在娱乐、购物、旅游时要讲究文明、保护环境。 ①用过的聚乙烯塑料食品袋要投入贴有可回收物标志的垃圾箱中。聚乙烯的结构简式是____。 ②不法商贩会用由铜锌合金打造的假金首饰欺骗消费者。请写出检验金首饰真假的化学方法和结论____。 ③不能携带烟花爆竹乘坐公共交通工具。制作烟花爆竹的黑火药是用木炭、硝酸钾、硫磺配制,黑火药爆炸时会生成氮气、硫化钾和二氧化碳。写出该反应的化学方程式____。 (3)在外出行要注意饮食健康。 ①面包、牛奶是常见的食物之一,面包对人体的主要作用是____。牛奶中的蛋白质在人体内水解可生成____。 ②为保证营养均衡,应摄入适量蔬菜。蔬菜中的膳食纤维对人体的作用是____。 ③橙汁是常用饮品。某品牌橙汁中含有维生素C、白砂糖、精制盐、柠檬黄和苯甲酸钠等成分,这几种物质中属于着色剂的是____。缺少维生素C可能会引发的疾病是____。 ④饮食不当会引起胃痛。胃舒平[主要成分是Al(OH)3]可治疗胃酸过多,写出Al(OH)3与胃酸反应的离子方程式____。 |
|
| 25. 综合题 | 详细信息 |
|
(1)根据有机化合物分子中所含官能团,可对其进行分类和性质预测。 ①下列有机化合物属于醇类物质的是____(填字母)。 a.CH3CH2OH b.CH3CHO c. ②下列有机化合物中加入浓溴水能生成白色沉淀的是____(填字母)。 a.CH2=CH2 b.苯 c. ③下列有机化合物能发生水解反应的是____(填字母)。 a.乙酸 b.油脂 c.葡萄糖 (2)有机物W( ①W分子中所含官能团的名称为____和____。 ②W分子中处于同一平面的碳原子最多有____个。 ③1mol W分子最多能与____mol H2发生加成反应。 (3)对羟基苯甲酸乙酯(  )是常用的食品防腐剂,可通过以下方法合成: )是常用的食品防腐剂,可通过以下方法合成: A C D E ①C→D的反应类型为____。 ②B的结构简式为____。 ③D与碳酸氢钠反应后所得有机物的结构简式为____。 ④D→E反应的化学方程式为____。 ⑤写出同时满足下列条件的C的一种同分异构体的结构简式:____。 Ⅰ.能和FeCl3溶液发生显色反应; Ⅱ.能发生银镜反应,不能发生水解反应; Ⅲ.分子中含有4种不同化学环境的氢原子。 |
|
| 26. 推断题 | 详细信息 |
有关物质的转化关系如下图所示。A是常见的无色液体,B是海水中最多的盐,D、F、J均为气体,C是石灰乳,L是石灰石,M具有漂白性,G、K均具有磁性,其中K为常见的金属单质。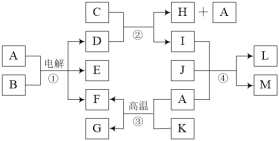 (1)E的化学式为____。 (2)A的电子式为____。 (3)写出反应③的化学方程式:____。 (4)写出反应④的离子方程式:____。 |
|
| 27. 综合题 | 详细信息 |
碱式硫酸铝[(1−x)Al2(SO4)3·xAl(OH)3]溶液可用于烟气脱硫。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝溶液,实验流程如下: 已知“调pH”的反应为:(2−x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1−x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑ (1)“酸浸”时反应的化学方程式为____。 (2)“酸浸”时适当增大H2SO4溶液浓度的目的是____,能达到相同目的的方法还有____(任写一种)。 (3)“酸浸”时应控制H2SO4溶液的用量,H2SO4溶液用量不能过量太多的原因是____。 (4)通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下: ①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。 ②取碱式硫酸铝溶液2.50 mL,加入0.1000 mol·L−1 EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L−1 CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。 计算(1−x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)____。 |
|
最近更新



