й«ҳдёүеҢ–еӯҰдёӢеҶҢдё“йўҳз»ғд№ еңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ
| 1. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘йҘұе’ҢNa2CO3жә¶ж¶ІдёӯйҖҡе…Ҙи¶ійҮҸCO2пјҢз»“жһңжңүжҷ¶дҪ“жһҗеҮәпјҢеҜ№жһҗеҮәжҷ¶дҪ“зҡ„еҺҹеӣ еҲҶжһҗдёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү A.зӣёеҗҢжё©еәҰдёӢNaHCO3зҡ„жә¶и§ЈеәҰе°ҸдәҺNa2CO3 B.жә¶ж¶Ідёӯжә¶еүӮеҮҸе°‘дәҶ C.жә¶иҙЁиҙЁйҮҸеўһеҠ дәҶ D.еҸҚеә”иҝҮзЁӢж”ҫзғӯ |
|
| 2. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺеҢ–е·Ҙз”ҹдә§еҺҹзҗҶзҡ„еҮ з§ҚеҸҷиҝ°дёӯпјҢеқҮз¬ҰеҗҲзӣ®еүҚе·Ҙдёҡз”ҹдә§е®һйҷ…жғ…еҶөзҡ„жҳҜ(гҖҖгҖҖ)гҖӮ A.зҹіжІ№жҳҜзғғзҡ„ж··еҗҲзү©пјҢзҹіжІ№е·ҘдёҡдёӯйҮҮз”Ёе№ІйҰҸзҡ„ж–№жі•жҠҠзҹіжІ№еҲҶжҲҗдёҚеҗҢжІёзӮ№иҢғеӣҙзҡ„дә§зү© B.ж°Ҝж°”е’Ңж°ўж°”ж··еҗҲеңЁе…үз…§жқЎд»¶дёӢз”ҹжҲҗж°ҜеҢ–ж°ўпјҢеҶҚз”Ёж°ҙеҗёж”¶з”ҹжҲҗзӣҗй…ё C.дәҢж°§еҢ–зЎ«еңЁжҺҘи§Ұе®Өиў«ж°§еҢ–жҲҗдёүж°§еҢ–зЎ«пјҢеҶҚеңЁеҗёж”¶еЎ”еҶ…иў«ж°ҙеҗёж”¶еҲ¶жҲҗжө“зЎ«й…ё D.еҗҲжҲҗж°Ёе·ҘдёҡдёӯпјҢз”ұдәҺж°Ёжҳ“ж¶ІеҢ–пјҢN2гҖҒH2еҫӘзҺҜдҪҝз”ЁпјҢжүҖд»ҘжҖ»дҪ“жқҘиҜҙж°Ёзҡ„дә§зҺҮеҫҲй«ҳ |
|
| 3. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁзЎ«й“ҒзҹҝеҒҡеҺҹж–ҷпјҢз”ЁжҺҘи§Ұжі•з”ҹдә§зЎ«й…ёзҡ„иҝҮзЁӢдёӯпјҢеҜ№еәҹејғиө„жәҗзҡ„еӨ„зҗҶдёҚжӯЈзЎ®зҡ„жҳҜ (гҖҖгҖҖ) A.ж°ЁвҖ”й…ёжі•е°ҫж°”и„ұзЎ«жҳҜе…Ҳе°Ҷе°ҫж°”з”Ёж°Ёж°ҙеҗёж”¶пјҢ然еҗҺеҶҚз”Ёжө“зЎ«й…ёеӨ„зҗҶ B.дёҺе°ҫж°”и„ұзЎ«жҠҖжңҜзӣёжҜ”пјҢдёӨиҪ¬дёӨеҗёжөҒзЁӢжҠ•иө„иҫғе°‘пјҢдҪҶиҝҗиЎҢиҙ№з”ЁзӣёеҜ№иҫғй«ҳ C.еҸҜд»Ҙд»ҺеҲ¶зЎ«й…ёжҺ’еҮәзҡ„зғ§жёЈдёӯеӣһ收й“ҒгҖҒжңүиүІйҮ‘еұһд»ҘеҸҠиҙөйҮҚйҮ‘еұһйҮ‘е’Ң银 D.жІёи…ҫзӮүж—ҒеҸҜд»Ҙи®ҫзҪ®вҖңеәҹзғӯвҖқй”…зӮүпјҢеҲ©з”ЁдҪҷзғӯдә§з”ҹзҡ„и’ёжұҪжқҘеҸ‘з”өжҲ–дҫӣзғӯ |
|
| 4. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
жҲ‘们йҘ®з”Ёзҡ„ж°ҙжҳҜз”ұжәҗж°ҙеҮҖеҢ–жүҖеҫ—гҖӮе·ІзҹҘпјҢжҳҺзҹҫиғҪе°Ҷж°ҙдёӯзҡ„жӮ¬жө®зү©еҮқиҒҡиҖҢжІүж·ҖпјҢж°Ҝж°”еҸҜжқҖиҸҢгҖӮ家еәӯйҘ®з”Ёж°ҙзҡ„еҮҖеҢ–иҝҮзЁӢжӯЈзЎ®зҡ„жҳҜ (гҖҖгҖҖ)гҖӮ A.жәҗж°ҙвҶ’иҝҮж»ӨвҶ’еҠ ж°Ҝж°”вҶ’еҠ жҳҺзҹҫвҶ’жІүж·ҖвҶ’еҮҖж°ҙ B.жәҗж°ҙвҶ’еҠ ж°Ҝж°”вҶ’иҝҮж»ӨвҶ’еҠ жҳҺзҹҫвҶ’жІүж·ҖвҶ’еҮҖж°ҙ C.жәҗж°ҙвҶ’еҠ жҳҺзҹҫвҶ’еҠ ж°Ҝж°”вҶ’иҝҮж»ӨвҶ’жІүж·ҖвҶ’еҮҖж°ҙ D.жәҗж°ҙвҶ’еҠ жҳҺзҹҫвҶ’жІүж·ҖвҶ’иҝҮж»ӨвҶ’еҠ ж°Ҝж°”вҶ’еҮҖж°ҙ |
|
| 5. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іе·Ҙдёҡз”ҹдә§зҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A.еҗҲжҲҗж°Ёз”ҹдә§иҝҮзЁӢдёӯе°ҶNH3ж¶ІеҢ–еҲҶзҰ»пјҢеҸҜеҠ еҝ«жӯЈеҸҚеә”йҖҹзҺҮпјҢжҸҗй«ҳN2гҖҒH2зҡ„иҪ¬еҢ–зҺҮ B.зЎ«й…ёеҺӮйқ иҝ‘еҺҹж–ҷдә§ең°жҜ”йқ иҝ‘зЎ«й…ёж¶Ҳиҙ№дёӯеҝғжӣҙдёәжңүеҲ© C.з”ұдәҺ2SO2(g)пјӢO2(g) D.е……еҲҶеҲ©з”ЁзЎ«й…ёеҺӮз”ҹдә§иҝҮзЁӢдёӯдә§з”ҹзҡ„вҖңеәҹзғӯвҖқпјҢеҸҜдҪҝзЎ«й…ёеҺӮеҗ‘еӨ–з•Ңиҫ“еҮәеӨ§йҮҸзҡ„иғҪйҮҸ |
|
| 6. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
дёӢиЎЁдёӯзҡ„жұЎжҹ“дёҺе…¶жқҘжәҗдёҚеҜ№еә”зҡ„жҳҜ
|
||||||||||||||||
| 7. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
1791е№ҙпјҢжі•еӣҪеҢ»з”ҹи·Ҝеёғе…°йҰ–е…ҲиҺ·еҫ—еҲ¶зўұдё“еҲ©пјҢд»ҘйЈҹзӣҗгҖҒжө“зЎ«й…ёгҖҒзҹізҒ°зҹігҖҒз…ӨдёәеҺҹж–ҷеҲ¶зўұпјҢиҜҘж–№жі•еҲҶдёүжӯҘпјҡ в‘ з”ЁNaClдёҺH2SO4еҸҚеә”еҲ¶Na2SO4пјӣ2NaClпјӢH2SO4 в‘Ўз”Ёз„ҰзӮӯиҝҳеҺҹNa2SO4еҲ¶Na2SпјӣNa2SO4пјӢ4C в‘ўз”ЁзЎ«еҢ–й’ дёҺзҹізҒ°зҹіеҸҚеә”еҲ¶Na2CO3пјӣNa2SпјӢCaCO3 дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү A.в‘Ўв‘ўдёӨжӯҘйғҪжҳҜж°§еҢ–иҝҳеҺҹеҸҚеә” B.еҸӘжңү第②жӯҘжҳҜж°§еҢ–иҝҳеҺҹеҸҚеә” C.иҜҘж–№жі•еҜ№з”ҹдә§и®ҫеӨҮеҹәжң¬жІЎжңүи…җиҡҖ D.иҜҘж–№жі•еҜ№зҺҜеўғжұЎжҹ“иҫғе°Ҹ |
|
| 8. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁвҖңз»ҝиүІеҢ–еӯҰе·ҘиүәвҖқдёӯпјҢзҗҶжғізҠ¶жҖҒжҳҜеҸҚеә”зү©дёӯзҡ„еҺҹеӯҗе…ЁйғЁиҪ¬еҢ–дёәж¬ІеҲ¶еҫ—зҡ„дә§зү©пјҢеҚіеҺҹеӯҗеҲ©з”ЁзҺҮдёә100%гҖӮдёӢеҲ—еҸҚеә”зұ»еһӢиғҪдҪ“зҺ°вҖңеҺҹеӯҗз»ҸжөҺжҖ§вҖқеҺҹеҲҷзҡ„жҳҜпјҲ пјү в‘ зҪ®жҚўеҸҚеә”гҖҖв‘ЎеҢ–еҗҲеҸҚеә”гҖҖв‘ўеҲҶи§ЈеҸҚеә”гҖҖв‘ЈеҸ–д»ЈеҸҚеә”гҖҖв‘ӨеҠ жҲҗеҸҚеә”гҖҖв‘Ҙж¶ҲеҺ»еҸҚеә”гҖҖв‘ҰеҠ иҒҡеҸҚеә”гҖҖ⑧缩иҒҡеҸҚеә” A.в‘ в‘Ўв‘Ө B.в‘Ўв‘Өв‘Ұ C.в‘Ұ⑧ D.в‘Ұ |
|
| 9. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
е·Ҙдёҡз”ҹдә§дёӯзү©иҙЁзҡ„еҫӘзҺҜеҲ©з”ЁжңүеӨҡз§ҚжЁЎејҸгҖӮдҫӢеҰӮпјҡ дёӢеҲ—иЎЁиҝ°жӯЈзЎ®зҡ„жҳҜ (гҖҖгҖҖ)гҖӮ A.еӣҫв… еҸҜз”ЁдәҺеҗҲжҲҗж°ЁдёӯN2гҖҒH2зҡ„еҫӘзҺҜ B.еӣҫв… еҸҜз”ЁдәҺж°Ёзўұжі•еҲ¶зәҜзўұдёӯCO2зҡ„еҫӘзҺҜ C.еӣҫв…ЎеҸҜз”ЁдәҺз”өи§ЈйҘұе’ҢйЈҹзӣҗж°ҙдёӯNaClзҡ„еҫӘзҺҜ D.еӣҫв…ўеҸҜз”ЁдәҺж°Ёж°§еҢ–жі•еҲ¶зЎқй…ёдёӯNOзҡ„еҫӘзҺҜ |
|
| 10. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іеҢ–е·Ҙз”ҹдә§зҡ„дё»иҰҒи®ҫеӨҮеҸҠе°ҫж°”зҡ„дё»иҰҒжҲҗеҲҶе®Ңе…ЁжӯЈзЎ®зҡ„жҳҜ A.зӮјй“ҒвҖ”з”өзӮүвҖ”COгҖҒCO2гҖҒN2 B.ж°Ёж°”вҖ”ж°§еҢ–зӮүвҖ”N2гҖҒH2 C.зӮјй’ўвҖ”иҪ¬зӮүвҖ”Fe2O3гҖҒCO D.зЎ«й…ёвҖ”еҗҲжҲҗеЎ”вҖ”SO2гҖҒSO3 |
|
| 11. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҲ¶дҪң铅笔зҡ„жқҗж–ҷдёҺзӣёеә”е·ҘдёҡдёҚеҜ№еә”зҡ„жҳҜ AпјҺж©Ўзҡ®ж“ҰвҖ”вҖ”ж©Ўиғ¶е·Ҙдёҡ BпјҺй“қеҗҲйҮ‘зүҮвҖ”вҖ”еҶ¶йҮ‘е·Ҙдёҡ CпјҺй“қ笔иҠҜвҖ”вҖ”з”өй•Җе·Ҙдёҡ DпјҺ铅笔жјҶвҖ”вҖ”ж¶Ӯж–ҷе·Ҙдёҡ |
|
| 12. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дҝқжҠӨзҺҜеўғжҳҜжҜҸдёӘе…¬ж°‘зҡ„иҙЈд»»гҖӮдёӢеҲ—еҒҡжі•пјҡв‘ жҺЁе№ҝдҪҝз”Ёж— зЈ·жҙ—ж¶ӨеүӮв‘ЎеҹҺеёӮз”ҹжҙ»еһғеңҫеҲҶзұ»еӨ„зҗҶв‘ўжҺЁе№ҝдҪҝз”ЁдёҖж¬ЎжҖ§зӯ·еӯҗв‘ЈжҺЁе№ҝдҪҝз”Ёжё…жҙҒиғҪжәҗв‘ӨиҝҮйҮҸдҪҝз”ЁеҢ–иӮҘгҖҒеҶңиҚҜв‘ҘжҺЁе№ҝдҪҝз”Ёж— ж°ҹеҶ°з®ұгҖӮе…¶дёӯжңүеҲ©дәҺдҝқжҠӨзҺҜеўғзҡ„жҳҜпјҲ пјү A.в‘ в‘Ўв‘Јв‘Ө B.в‘ в‘Ўв‘Јв‘Ҙ C.в‘Ўв‘ўв‘Јв‘Ҙ D.в‘ўв‘Јв‘Өв‘Ҙ |
|
| 13. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
2013е№ҙ3жңҲ22ж—ҘжҳҜ第дәҢеҚҒдёҖдёӘвҖңдё–з•Ңж°ҙж—ҘвҖқпјҢе®Јдј дё»йўҳжҳҜвҖңж°ҙеҗҲдҪңвҖқгҖӮжҲ‘еӣҪзәӘеҝөвҖңдё–з•Ңж°ҙж—ҘвҖқе’ҢејҖеұ•вҖңдёӯеӣҪж°ҙе‘ЁвҖқжҙ»еҠЁзҡ„е®Јдј дё»йўҳдёәвҖңиҠӮзәҰдҝқжҠӨж°ҙиө„жәҗпјҢеӨ§еҠӣе»әи®ҫз”ҹжҖҒж–ҮжҳҺвҖқгҖӮдёӢеҲ—жңүе…іжҙ»еҠЁдёҚз¬ҰеҗҲиҝҷдёҖдё»йўҳзҡ„жҳҜ A.еҠ ејәе·Ҙдёҡз”Ёж°ҙзі»з»ҹзҡ„зҺҜдҝқж”№йҖ пјҢжҸҗй«ҳж°ҙзҡ„йҮҚеӨҚеҲ©з”ЁзҺҮ B.еҠ ејәеҹҺеёӮз”ҹжҙ»жұЎж°ҙеӨ„зҗҶпјҢеқҡжҢҒиҫҫж ҮжҺ’ж”ҫ C.еҠ еҝ«дә§дёҡз»“жһ„и°ғж•ҙпјҢе»әз«Ӣж°ҙиө„жәҗиҠӮзәҰеһӢгҖҒзҺҜдҝқеһӢзҡ„еӣҪж°‘з»ҸжөҺдҪ“зі» D.жҺЁе№ҝдҪҝз”ЁзәҜеҮҖж°ҙд»ЈжӣҝиҮӘжқҘж°ҙдҪңз”ҹжҙ»з”Ёж°ҙпјҢд»Ҙдҝқйҡңз”Ёж°ҙе®үе…Ё |
|
| 14. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
еҰӮдёӢеӣҫжүҖзӨәпјҢеҲ©з”Ёжө·ж°ҙеҸҜжҸҗеҸ–еҫҲеӨҡйҮҚиҰҒзҡ„еҢ–е·ҘеҺҹж–ҷгҖӮ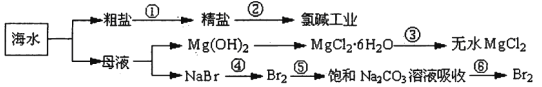 дёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҺ( )гҖӮ A.第①жӯҘдёӯйҷӨеҺ»зІ—зӣҗдёӯзҡ„SO42пјҚгҖҒCa2пјӢгҖҒMg2пјӢгҖҒFe3пјӢзӯүжқӮиҙЁпјҢеҠ е…Ҙзҡ„иҚҜе“ҒйЎәеәҸдёәпјҡNa2CO3жә¶ж¶ІвҶ’NaOHжә¶ж¶ІвҶ’BaCl2жә¶ж¶ІвҶ’иҝҮж»ӨеҗҺеҠ зӣҗй…ё B.第②жӯҘдёӯе·ҘдёҡдёҠеҸҜйҮҮз”ЁзҹіеўЁдёәйҳҙжһҒпјҢй“ҒдёәйҳіжһҒпјҢйҮҮз”ЁйҳізҰ»еӯҗдәӨжҚўиҶңзҡ„з”өи§ЈиЈ…зҪ® C.第③жӯҘдёӯз»“жҷ¶еҮәзҡ„MgCl2В·6H2OеҸҜеңЁз©әж°”дёӯеҸ—зғӯеҲҶи§ЈеҲ¶ж— ж°ҙMgCl2 D.еңЁз¬¬в‘ЈжӯҘдёӯжәҙе…ғзҙ иў«ж°§еҢ–пјҢ第в‘ӨгҖҒв‘ҘжӯҘдёӯж—ўжңүжәҙе…ғзҙ иў«ж°§еҢ–д№ҹжңүжәҙе…ғзҙ иў«иҝҳеҺҹ |
|
| 15. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
д»Һе…үеҗҲдҪңз”Ёзҡ„еҸҚеә”еҺҹзҗҶ6CO2+6H2O AпјҺзј“и§Јең°зҗғжё©е®Өж•Ҳеә”пјҢжҠ‘еҲ¶еҶңдҪңзү©иҗҘе…»е№іиЎЎ BпјҺеҠ еү§ең°зҗғжё©е®Өж•Ҳеә”пјҢдҝғиҝӣеҶңдҪңзү©иҗҘе…»е№іиЎЎ CпјҺзј“и§Јең°зҗғжё©е®Өж•Ҳеә”пјҢдҝғиҝӣеҶңдҪңзү©иҗҘе…»е№іиЎЎ DпјҺеҠ еү§ең°зҗғжё©е®Өж•Ҳеә”пјҢжҠ‘еҲ¶еҶңдҪңзү©иҗҘе…»е№іиЎЎ |
|
| 16. з»јеҗҲйўҳ | иҜҰз»ҶдҝЎжҒҜ |
з”өи§ЈеҺҹзҗҶеңЁеҢ–еӯҰе·Ҙдёҡдёӯжңүе№ҝжіӣеә”з”ЁгҖӮдёӢеӣҫиЎЁзӨәдёҖдёӘз”өи§Јжұ пјҢиЈ…жңүз”өи§Јж¶ІaпјӣXгҖҒYжҳҜдёӨеқ—з”өжһҒжқҝпјҢйҖҡиҝҮеҜјзәҝдёҺзӣҙжөҒз”өжәҗзӣёиҝһгҖӮиҜ·еӣһзӯ”д»ҘдёӢй—®йўҳпјҡ (1)иӢҘXгҖҒYйғҪжҳҜжғ°жҖ§з”өжһҒпјҢaжҳҜйҘұе’ҢNaClжә¶ж¶ІпјҢе®һйӘҢејҖе§Ӣж—¶пјҢеҗҢж—¶еңЁдёӨиҫ№еҗ„ж»ҙе…ҘеҮ ж»ҙй…ҡй…һиҜ•ж¶ІпјҢеҲҷпјҡ в‘ еңЁXжһҒйҷ„иҝ‘и§ӮеҜҹеҲ°зҡ„зҺ°иұЎжҳҜ_________________________________________гҖӮ в‘ЎYз”өжһҒдёҠзҡ„з”өжһҒеҸҚеә”ејҸдёә___________________________________гҖӮ (2)еҰӮз”Ёз”өи§Јж–№жі•зІҫзӮјзІ—й“ңпјҢз”өи§Јж¶ІaйҖүз”ЁCuSO4жә¶ж¶ІпјҢеҲҷ в‘ Xз”өжһҒзҡ„жқҗж–ҷжҳҜ_______пјҢз”өжһҒеҸҚеә”ејҸдёә__________________________гҖӮ в‘ЎYз”өжһҒзҡ„жқҗж–ҷжҳҜ_______ (3)е·Ҙдёҡе“Ғж°ўж°§еҢ–й’ҫзҡ„жә¶ж¶Ідёӯеҗ«жңүжҹҗдәӣеҗ«ж°§й…ёжқӮиҙЁпјҢеҸҜз”ЁзҰ»еӯҗдәӨжҚўиҶңжі•з”өи§ЈжҸҗзәҜгҖӮз”өи§Јж§ҪеҶ…иЈ…жңүйҳізҰ»еӯҗдәӨжҚўиҶң(еҸӘе…Ғи®ёйҳізҰ»еӯҗйҖҡиҝҮ)пјҢе…¶е·ҘдҪңеҺҹзҗҶеҰӮеӣҫжүҖзӨәгҖӮ в‘ иҜҘз”өи§Јж§Ҫзҡ„йҳіжһҒеҸҚеә”ејҸжҳҜ_____________________гҖӮ в‘ЎйҖҡз”өејҖе§ӢеҗҺпјҢйҳҙжһҒйҷ„иҝ‘жә¶ж¶ІpHдјҡеўһеӨ§пјҢиҜ·з®Җиҝ°еҺҹеӣ ________________гҖӮ в‘ўйҷӨеҺ»жқӮиҙЁеҗҺзҡ„ж°ўж°§еҢ–й’ҫжә¶ж¶Ід»Һжә¶ж¶ІеҮәеҸЈ________(еЎ«еҶҷвҖңAвҖқжҲ–вҖңBвҖқ)еҜјеҮәгҖӮ  |
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
д»Һжө·ж°ҙдёӯеҸҜжҸҗеҸ–еӨҡз§ҚеҢ–е·ҘеҺҹж–ҷпјҢдёӢйқўжҳҜе·ҘдёҡдёҠеҜ№жө·ж°ҙжҲҗеҲҶз»јеҗҲеҲ©з”Ёзҡ„зӨәж„ҸеӣҫгҖӮ иҜ•еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)еҶҷеҮәз”Ёжө·ж»©дёҠзҡ„иҙқеЈіеҲ¶Ca(OH)2зҡ„еҢ–еӯҰж–№зЁӢејҸ_________________________гҖӮ (2)еҶҷеҮәз”өи§ЈйҘұе’ҢNaClжә¶ж¶Ізҡ„еҢ–еӯҰж–№зЁӢејҸ___________________________________гҖӮ (3)е°Ҷз”өи§Јз”ҹжҲҗзҡ„ж°Ҝж°”йҖҡе…ҘзҹізҒ°д№ідёӯеҸҜеҲ¶еҫ—жјӮзҷҪзІүпјҢеҶҷеҮәе…¶еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ_______________________гҖӮ (4)з”Ёжө·ж»©дёҠзҡ„иҙқеЈіеҲ¶Ca(OH)2иҖҢдёҚд»ҺејӮең°еұұдёӯејҖеҮҝзҹізҒ°зҹіеҲ¶еҸ–пјҢдё»иҰҒиҖғиҷ‘еҲ°д»Җд№Ҳй—®йўҳпјҹ_________________________________гҖӮ |
|
| 18. з»јеҗҲйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеӣҫжҳҜе·Ҙдёҡз”ҹдә§дёӯеҗҲжҲҗж°ЁжөҒзЁӢзӨәж„ҸеӣҫпјҢд»”з»Ҷи§ӮеҜҹеӣҫзӨәдёӯзҡ„зү©иҙЁеҸҳеҢ–е…ізі»еҸҠе·Ҙиүәзү№зӮ№пјҢеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)еҗҲжҲҗж°Ёзҡ„ж•ҙдёӘе·Ҙдёҡз”ҹдә§еҢ…жӢ¬йҖ ж°”гҖҒеҮҖеҢ–гҖҒеҗҲжҲҗж°ЁдёүеӨ§йғЁеҲҶпјҢе…¶дёӯдёҠиҝ°е·ҘиүәжөҒзЁӢеӣҫзӨәдёӯе·Із»Ҹе°ҶйҖ ж°”дёҺеҮҖеҢ–иЈ…зҪ®з”Ёз«–зәҝеҲҶејҖпјҢиҜ·дҪ еңЁеӣҫзӨәдёӯеҶҚе°ҶеҮҖеҢ–дёҺеҗҲжҲҗж°ЁиЈ…зҪ®з”Ёз«–зәҝеҲҶејҖгҖӮ_______ 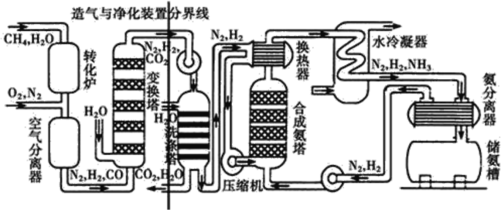 (2)еҗҲжҲҗж°Ёе·Ҙдёҡдёӯзҡ„ж°ўж°”жқҘжәҗдәҺеӨ©з„¶ж°”гҖҒз…Өзӯүзү©иҙЁпјҢж №жҚ®еӣҫзӨәзү©иҙЁзҡ„еҸҳеҢ–е…ізі»еҶҷеҮәдёӨдёӘз”ҹжҲҗж°ўж°”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ _______________пјӣ_______гҖӮ (3)еҮҖеҢ–иЈ…зҪ®дёӯеҸҜд»Ҙж¶ҲйҷӨйҖ ж°”иҝҮзЁӢдёӯдә§з”ҹзҡ„жқӮиҙЁпјҢзӣ®зҡ„жҳҜ______________________гҖӮ (4)зӣ®еүҚеӣҪ家еҖЎеҜјиҠӮиғҪеҮҸжҺ’пјҢи§ӮеҜҹдёҠиҝ°е·ҘиүәжөҒзЁӢеӣҫзӨәпјҢеҶҷеҮәеҗҲжҲҗж°Ёе·ҘдёҡдёӯиҠӮиғҪеҮҸжҺ’зҡ„дёӨйЎ№жҺӘж–Ҫ_______________________гҖӮ |
|
| 19. и®Ўз®—йўҳ | иҜҰз»ҶдҝЎжҒҜ |
| й“Ғзҡ„жҹҗз§Қж°§еҢ–зү©20 gпјҢеңЁеҠ зғӯзҡ„жқЎд»¶дёӢйҖҡе…Ҙи¶ійҮҸзҡ„COе®Ңе…ЁеҸҚеә”пјҢе°Ҷз”ҹжҲҗзҡ„ж°”дҪ“з”ЁзҹізҒ°ж°ҙеҗёж”¶пјҢеҫ—еҲ°жІүж·Җ37.5 gпјҢжұӮиҜҘж°§еҢ–зү©дёӯй“Ғе…ғзҙ дёҺж°§е…ғзҙ зҡ„иҙЁйҮҸжҜ”гҖӮ_________ | |
| 20. з»јеҗҲйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
зЎ«й…ёе·ҘдёҡеңЁеӣҪж°‘з»ҸжөҺдёӯеҚ жңүжһҒе…¶йҮҚиҰҒзҡ„ең°дҪҚгҖӮ (1)зЎ«й…ёзҡ„жңҖеӨ§ж¶Ҳиҙ№жё йҒ“жҳҜеҢ–иӮҘе·ҘдёҡпјҢз”ЁзЎ«й…ёеҲ¶йҖ зҡ„еёёи§ҒеҢ–иӮҘжңү________(д»»еҶҷдёҖз§Қ)гҖӮ (2)зЎ«й…ёз”ҹдә§дёӯпјҢж №жҚ®еҢ–еӯҰе№іиЎЎеҺҹзҗҶжқҘзЎ®е®ҡзҡ„жқЎд»¶жҲ–жҺӘж–Ҫжңү________(еЎ«еҶҷеәҸеҸ·)гҖӮ AпјҺзҹҝзҹіеҠ е…ҘжІёи…ҫзӮүд№ӢеүҚе…ҲзІүзўҺ BпјҺдҪҝз”ЁV2O5дҪңеӮ¬еҢ–еүӮ CпјҺиҪ¬еҢ–еҷЁдёӯдҪҝз”ЁйҖӮе®ңзҡ„жё©еәҰ DпјҺеҮҖеҢ–еҗҺзҡ„зӮүж°”дёӯиҰҒжңүиҝҮйҮҸзҡ„з©әж°” EпјҺеӮ¬еҢ–ж°§еҢ–еңЁеёёеҺӢдёӢиҝӣиЎҢ FпјҺеҗёж”¶еЎ”дёӯз”Ё98.3%зҡ„жө“зЎ«й…ёеҗёж”¶SO3 (3)еңЁзЎ«й…ёе·ҘдёҡдёӯпјҢйҖҡиҝҮдёӢеҲ—еҸҚеә”дҪҝдәҢж°§еҢ–зЎ«иҪ¬еҢ–дёәдёүж°§еҢ–зЎ«пјҡ2SO2(g)пјӢ (4)зЎ«й…ёзҡ„е·ҘдёҡеҲ¶жі•иҝҮзЁӢж¶үеҸҠдёүдёӘдё»иҰҒзҡ„еҢ–еӯҰеҸҚеә”еҸҠзӣёеә”зҡ„и®ҫеӨҮ(жІёи…ҫзӮүгҖҒиҪ¬еҢ–еҷЁгҖҒеҗёж”¶еЎ”)гҖӮ в‘ дёүдёӘи®ҫеӨҮеҲҶеҲ«дҪҝеҸҚеә”зү©д№Ӣй—ҙжҲ–еҶ·зғӯж°”дҪ“д№Ӣй—ҙиҝӣиЎҢвҖңеҜ№жөҒвҖқгҖӮиҜ·з®ҖеҚ•жҸҸиҝ°еҗёж”¶еЎ”дёӯеҸҚеә”зү©д№Ӣй—ҙжҳҜжҖҺж ·еҜ№жөҒзҡ„гҖӮ______________________________гҖӮ в‘Ўе·Ҙдёҡз”ҹдә§дёӯеёёз”Ёж°ЁпјҚй…ёжі•иҝӣиЎҢе°ҫж°”и„ұзЎ«пјҢд»ҘиҫҫеҲ°ж¶ҲйҷӨжұЎжҹ“гҖҒеәҹзү©еҲ©з”Ёзҡ„зӣ®зҡ„гҖӮз”ЁеҢ–еӯҰж–№зЁӢејҸиЎЁзӨәе…¶еҸҚеә”еҺҹзҗҶгҖӮ(еҸӘеҶҷеҮә2дёӘж–№зЁӢејҸеҚіеҸҜ)________________________ |
|
| 21. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
й’ўй“Ғе·ҘдёҡеҜ№дҝғиҝӣз»ҸжөҺе’ҢзӨҫдјҡеҸ‘еұ•иө·дәҶйҮҚиҰҒдҪңз”ЁгҖӮ пјҲ1пјүзӮјй“Ғй«ҳзӮүеҲҶдёәдә”йғЁеҲҶпјҢй“ҒзҹҝзҹідёҺй«ҳжё©з…Өж°”дё»иҰҒеңЁ_________________йғЁеҲҶеҸ‘з”ҹеҸҚеә”пјҢеңЁ_____________йғЁеҲҶејҖе§Ӣз”ҹжҲҗй“Ғе’ҢзӮүжёЈгҖӮ пјҲ2пјүзӮјй’ўж—¶пјҢйҷӨзЈ·зҡ„еҢ–еӯҰж–№зЁӢејҸдёә________________________________пјӣеҠ е…ҘзЎ…гҖҒй”°е’Ңй“қзҡ„зӣ®зҡ„жҳҜ________________________________________гҖӮ пјҲ3пјүдёҚй”Ҳй’ўеҗ«жңүзҡ„Crе…ғзҙ жҳҜеңЁзӮјй’ўиҝҮзЁӢзҡ„ж°§еҗ№_____пјҲеЎ«вҖңеүҚвҖқжҲ–вҖңеҗҺвҖқпјүеҠ е…ҘпјҢеҺҹеӣ жҳҜ______________________гҖӮ пјҲ4пјүзӮјй“Ғе’ҢзӮјй’ўз”ҹдә§дёӯпјҢе°ҫж°”еқҮеҗ«жңүзҡ„дё»иҰҒжұЎжҹ“зү©_______________________________гҖӮд»ҺзҺҜдҝқе’Ңз»ҸжөҺи§’еәҰиҖғиҷ‘пјҢдёҠиҝ°е°ҫж°”з»ҸеӨ„зҗҶеҸҜз”ЁдҪң__________________________________гҖӮ |
|
| 22. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ«жңүеҶңиҚҜгҖҒжҹ“ж–ҷгҖҒй…ҡгҖҒж°°еҢ–зү©пјҢд»ҘеҸҠеј•иө·иүІеәҰгҖҒиҮӯе‘ізҡ„еәҹж°ҙпјҢеёёз”ЁеҢ–еӯҰж°§еҢ–жі•иҝӣиЎҢеӨ„зҗҶпјҢжүҖз”Ёзҡ„ж°§еҢ–еүӮжңүж°Ҝзұ»пјҲеҰӮж¶Іж°ҜгҖҒж¬Ўж°Ҝй…ёй’ҷгҖҒж¬Ўж°Ҝй…ёй’ зӯүпјүе’Ңж°§зұ»пјҲеҰӮз©әж°”гҖҒиҮӯж°§гҖҒиҝҮж°§еҢ–ж°ўгҖҒй«ҳй”°й…ёй’ҫзӯүпјүгҖӮдёҖдёӘе…ёеһӢе®һдҫӢжҳҜз”Ёж°Ҝж°§еҢ–жі•еӨ„зҗҶеҗ«жңүеү§жҜ’зҡ„ж°°еҢ–зү©пјҲеҗ«CNпјҚпјүзҡ„еәҹж°ҙгҖӮеңЁзўұжҖ§жқЎд»¶дёӢпјҲpHпјқ8.5пҪһ11пјүпјҢж°Ҝж°”еҸҜе°Ҷж°°еҢ–зү©дёӯCNпјҚж°§еҢ–дёәеҸӘжңүе®ғжҜ’жҖ§ пјҲ1пјүеҶҷеҮәеҗ«CNпјҚеәҹж°ҙз”Ёж°Ҝж°”ж°§еҢ–з”ҹжҲҗж°°й…ёзӣҗзҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ_________________гҖӮ пјҲ2пјүиӢҘеҗ‘еҗ«CNOпјҚзҡ„еәҹж°ҙдёӯеҶҚйҖҡе…Ҙж°Ҝж°”пјҢеҸҜдҪҝCNOпјҚиҪ¬еҢ–дёәж— жҜ’зҡ„ж°”дҪ“пјҢеҶҷеҮәиҝҷдёӘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ______________________________________________гҖӮ пјҲ3пјүеңЁз”Ёж¶Іж°ҜдёҚдҫҝзҡ„ең°еҢәпјҢеҸҜз”ЁжјӮзҷҪзІүеӨ„зҗҶеҗ«CNпјҚзҡ„еәҹж°ҙпјҢиӢҘе°Ҷе…¶ж°§еҢ–дёәCNOпјҚпјҢе…¶зҰ»еӯҗж–№зЁӢејҸдёә__________________________________________гҖӮ |
|
й«ҳдёӯеҢ–еӯҰ иҜ•еҚ·жҺЁиҚҗ
- з”ҳиӮғй«ҳдёҖеҢ–еӯҰжңҲиҖғжөӢйӘҢпјҲ2019е№ҙдёӢеҶҢпјүе®Ңж•ҙиҜ•еҚ·
- еӢҗи…ҠеҺҝ第дәҢдёӯеӯҰй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•еҗҢжӯҘиҖғиҜ•жЈҖжөӢ
- 2019еұҠй«ҳдёүдёӢеҚҠе№ҙ5жңҲиҙЁжЈҖзҗҶ科综еҗҲеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲзҰҸе»әзңҒе®Ғеҫ·еёӮпјү
- еұұдёң2019е№ҙй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹдёӯиҖғиҜ•иҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- й«ҳдёҖеҗҺеҚҠжңҹејҖеӯҰжөӢйӘҢеҚ·еҢ–еӯҰйўҳе…Қиҙ№еңЁзәҝжЈҖжөӢпјҲ2019-2020е№ҙеҶ…и’ҷеҸӨе‘је’Ңжө©зү№еёӮе’Ңжһ—ж је°”еҺҝ第дёҖдёӯеӯҰпјү
- е№ҝиҘҝжЎӮжў§й«ҳдёӯй«ҳдёҖеҢ–еӯҰжңҹжң«иҖғиҜ•пјҲ2018е№ҙдёҠеҶҢпјүе…Қиҙ№жЈҖжөӢиҜ•еҚ·
- й«ҳдёҖдёӢеҶҢ6жңҲжңҲиҖғеҢ–еӯҰеңЁзәҝиҖғиҜ•йўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲ2019-2020е№ҙе®үеҫҪзңҒйҳңйҳіеёӮйҳңеҚ—еҺҝе®һйӘҢдёӯеӯҰпјү
- з”ҳиӮғзңҒе…°е·һеёӮ第еӣӣзүҮеҢә2020-2021е№ҙй«ҳдәҢдёҠеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰж— зәёиҜ•еҚ·е®Ңж•ҙзүҲ
жңҖиҝ‘жӣҙж–°



