2019届高三前半期第一次调查研究考试理科综合化学(四川省乐山市)
| 1. | 详细信息 |
|
化学是材料、能源、环境、信息等现代科学技术的重要基础。下列说法不正确的是 A. 制造矢量发动机使用含铼(Re)合金材料,合金是纯净物 B. “人造太阳”的核燃料是氘、氚,12H、13H互为同位素 C. 在人体中检测出了“微塑料”,说明白色污染危害严重 D. 制造芯片的工艺中,用氢氟酸腐蚀硅是化学变化 |
|
| 2. | 详细信息 |
透明聚酯玻璃钢可用于制造宇航员面罩和导弹达罩。制备橐酯的一种配方中含有中基丙烯酸甲酯(MMA,结构简式如图。下列有关MMA的说法正确的是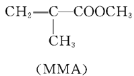 A. MMA易溶于水和有机溶剂 B. MMA的含氧官能团是羧基 C. MMA的一种同分异构体为CH3CH2 COOCH2CH3 D. MMA能发生加成反应、水解反应、氧化反应、加聚反应 |
|
| 3. | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法正确的是 A. 向1mol/ L NaOH溶液中加入27g铝,转移的电子数是3NA B. 常温常压下,28gN2与CO混合气体中的原子总数是2NA C. 标准状况下,22.4LNO与O2混合气体中的分子数为NA D. 1L0.1 mol/LNa2CO3溶液中所含有的阴离子总数为0.1NA |
|
| 4. | 详细信息 | |||||||||||||||
根据下列实验操作和现象所得到的实验结论正确的是
|
||||||||||||||||
| 5. | 详细信息 |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,已知:四种原了最外层电子数之和为24。下列说法止确的是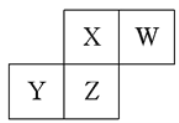 A. 元索Ⅹ和元Z的最高正化合价相同 B. 单核阴离子半径的大小顺序为:r(W)>r(X) C. 气态简单氢化物的热稳定性顺序为:Y<Z<X<W D. 元素Z的氧化物对应水化物都是强酸 |
|
| 6. | 详细信息 |
含氯苯的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其原理如图所示。下列叙述正确的是 A. 氯苯被氧化生成苯 B. N极为电池的负极 C. M极电极反应式为:C6H5Cl +e-=Cl-+ C6H6 D. 每生成1 mol CO2,由N极区进入M极区的H+为3mol |
|
| 7. | 详细信息 |
常温下向20mL0.10mol/LCH3COOH溶液中滴加0.10mol/ L NaOH溶液时,混合溶液的pH与相关微粒的浓度关系如图所示。已知:pKa=-lgKa。下列说法不正确的是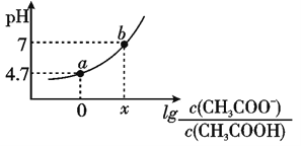 A. CH3COOH溶液中存在如下平衡:CH3COOH B. b点,加入NaOH溶液的体积小于20mL C. 将等物质的量的CH3COOH和CH3 COONa一起溶于蒸馏水中,得到对应a点的溶液 D. 常温下,CH3COOH的电离常数为Ka,则pKa=4.7 |
|
| 8. | 详细信息 |
|
铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下: (氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。 (氯化业铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通人氯化氢来生产无水氯化亚铁。 某化学活动小组用下图所示的装詈(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:  (1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为____。 (2)仪器D的名称是____;D中装的约品是碱石灰,其作用是____。 (3)定性分析。取C中的少量产物溶于稀盐酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的____(只能选取一种试剂,填序号)进行检测,实验现象是____。 ①H2O2溶液 ②K3[Fe(CN)6]溶液 ③KSCN溶液 ④酸性KMnO4溶液 ⑤KI一淀粉溶液 (4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中铁元素的质量分数为____%(结果精确到小数点后两位)。 (5)由(4)定量分析数据得出结论,并提出改进措施: ①用题目所给的装置制得的产物中,铁元素含量____(填“相等”、“偏高”或“偏低”),说明含有FeCl2杂质。 ②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是____。 |
|
| 9. | 详细信息 |
在体积为2L的真空密闭容器中加人1 mol CaCO3,发生反应:CaCO3(s) 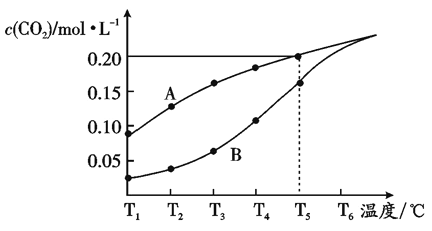 请回答下列问题: (1)已知:①CaO(s)+SO2(g)==CaSO3(s) △H1=-402kJ·mol-1 ②2CaCO3(s)+2SO2(g)+O2(g)==2CaSO4(s)+2CO2(g) △H2=-2762kJ·mol-1 ③2CaSO3(s)+O2(g)==2CaSO4(s) △H3=-2315kJ·mol-1 则:CaCO3(s)==CaO(s)+CO2(g)的△H=____kJ·mol-1 (2)①温度为T5℃时,反应CaCO3(s) ②如果该反应的平衡常数K值变大,该反应____(选填编号)。 A.一定向逆反应方向移动 B.在平衡移动时正反应速率先增大后减小 C.一定向正反应方向移动 D.在平衡移动时逆反应速率先减小后增大 (3)在T5℃下,维持温度和容器体积不变,充入CO2气体,则达到平衡时CaCO3的质量____(填“增大”、“减小”或“不变”)。 (4)在T5℃下,反应达到平衡状态后,再压缩容器为1L,重新达到平衡时,CO2的浓度____(填“增大”、“减小”或“不变”) (5)随着温度的升高,曲线B向曲线A逼近的原因是____。 |
|
| 10. | 详细信息 |
氧族元素碲(Te)是当今高新技术新材料的主要成分之一。已知:TeO2是两性氧化物。工业上常用“铜阳极泥”(主要含Cu2Te,还含少量Ag、Au)为原料制备单质碲,其工艺流程如图所示。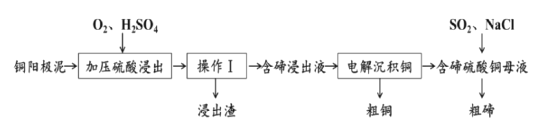 回答下列问题: (1)碲(Te)位于元素周期表第_________周期第ⅥA族;下列有关确的性质的叙述错误的是______。 A.碲的单质在常温下是固态 B.碲的常见化合价有-2、+4、+6 C.碲可能用作半导体材料 D.碲的氢化物H2Te很稳定 (2)实验室中“操作I”的名称是________,下列仪器与该实验操作无关的是________。 A.长颈漏斗 B.烧杯 C.锥形瓶 D.玻璃棒 E.容量瓶 (3)在“加压硫酸浸出”过程中,每消耗1mol Cu2Te反应生成TeOSO4,转移的电子数为________mol;“含硫浸出液”的溶质主要成分除TeOSO4外,还含有________(写化学式)。 (4)“电解沉积除铜”时,将“含酶浸出液”置于电解槽中,铜、确沉淀的关系如图所示。电解初始阶段阴极的电极反应式是__________。 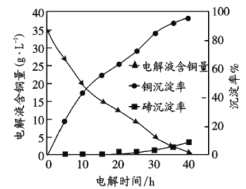 (5)①向“含确硫酸铜溶液”中通入SO2还原TeOSO4生成磅的化学方程式为__________。 ②上述反应在加入少量NaCl后,反应速率大幅度加快,则NaCl的主要作用为_____________。 |
|
| 11. | 详细信息 |
|
“张亭栋研究小组”受民间中医启发,发现As2O3对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)为第VA族元素,该族元素的化合物在研究和生产中有着许多重要用途。 (1)N原子的价电子排布式为______,N、P、As原子的第一电离能由大到小的顺序为______。 (2)NH3的沸点比AsH3的沸点高,原因是____________。 (3)立方氮化硼晶体(BN),是一种超硬材料,有优异的耐磨性,其晶胞如图所示。  ①立方氮化硼是_________晶体,晶体中N原子的杂化轨道类型为_________,A,B原子的配位数为_________。 ②立方氮化硼晶体中“一般共价键”与配位键的数目之比为_________。 (4)若立方氮化硼晶胞的边长为362 pm,则立方氮化硼的密度为_________g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。 |
|
| 12. | 详细信息 |
聚甲基丙烯酸羟乙酯(HEMA)是一种隐形眼镜的仿生材料,其单体的结构简式为: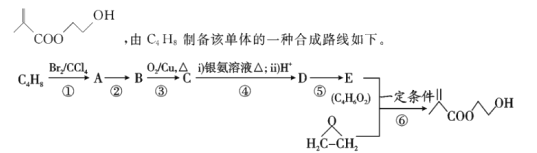 回答下列问题: (1)写出合成路线中C4H8的结构简式____________,写出它的系统命名法名称___________。 (2)D分子中含有的官能团名称为___________。 (3)反应②的试剂及条件为___________,反应⑤的反应类型为___________。 (4)写出反应⑥的化学方程式___________。 (5)写出由单体合成聚甲基丙烯酸羟乙酯(HEMA)的化学方程式___________。 (6)写出同时符合下列条件的C的同分异构体:___________。 ①能与NaHCO3溶液反应放出气体 ②核磁共振氢谱中有3组吸收峰 |
|
最近更新



