2016-2017年高一上半期化学期中考试考卷带参考答案和解析(浙江省杭州市西湖高级中学)
| 1. | 详细信息 |
下列图①②③原子结构模型中依次符合卢瑟福、道尔顿、汤姆生的观点的是( )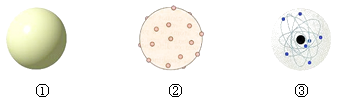 A.①②③ B.③①② C.③②① D.②①③ |
|
| 2. | 详细信息 | ||||||||||||||||||||
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的( )
|
|||||||||||||||||||||
| 3. | 详细信息 |
|
胶体区别于其它分散系最本质的特征是( ) A.外观透明澄清 B.分散质粒子直径介于1?100nm C.静置,不出现分层 D.有丁达尔现象 |
|
| 4. | 详细信息 |
|
不能用金属跟氯气直接反应制得的氯化物的是( ) A.FeCl2 B.MgCl2 C.CuCl2 D.NaCl |
|
| 5. | 详细信息 |
氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应中属于区域3的是( ) A.2K2O2+2CO2?2K2CO3+O2 B.Cl2+2KBr?Br2+2KCl C.4Fe(OH)2+O2+2H2O?4Fe(OH)3 D.2NaHCO3?Na2CO3+H2O+CO2↑ |
|
| 6. | 详细信息 |
|
设NA为阿伏伽德罗常数,下列说法不正确的是( ) A.2.0g重水(D2O)中含有的中子数为NA B.标准状况下22.4L的四氯化碳,含有四氯化碳分子数为NA C.23g金属钠变为钠离子时失去的电子数为NA D.常温常压下,48gO3和O2混合气体中含有的氧原子数为3NA |
|
| 7. | 详细信息 |
|
常温下,与100mL0.10mol/LMgCl2溶液中Cl?浓度相等的是( ) A.200mL0.1mol/LKCl溶液 B.200mL0.10mol/LNaCl溶液 C.200 mL 0.10mol/LBaCl2溶液 D.100mL0.1mol/LAl2(SO4)3溶液 |
|
| 8. | 详细信息 |
|
对于HD的描述,不正确的是( ) A.在受热条件下,HD能还原氧化铜 B.HD能在氯气中燃烧生成HCl和DCl气体 C.是一种非金属单质 D.是一种化合物 |
|
| 9. | 详细信息 |
|
下列配制溶液的操作中,不会影响所配溶液浓度大小的是…( ) A.托盘两边各垫一张质量相等的纸片称取固体NaOH B.容量瓶内水分未干便注入了液体 C.洗涤刚才盛过溶质的烧杯的洗涤液没有转入容量瓶 D.定容后使溶液混匀,静止,发现凹液面低于刻度线,立即滴加蒸馏水至刻度线 |
|
| 10. | 详细信息 |
|
V mL Al2(SO4)3溶液中含Al3+a g,取 A. B. C. D. |
|
| 11. | 详细信息 |
|
下列各物质的分类、名称(或俗名)、化学式都正确的是( ) A.酸性氧化物 干冰 CO2 B.碱 纯碱 Na2CO3 C.酸 硫酸 H2SO3 D.单质 氯水 Cl2 |
|
| 12. | 详细信息 |
|
下列叙述不正确的是( ) A.6Li和7Li的电子数相等,中子数也相等 B.1H和2H是不同的核素,它们的质子数相等 C.14C和14N的质量数相等,它们的中子数不等 D.13C和14C属于同一元素,它们互为同位素 |
|
| 13. | 详细信息 |
|
下列物质在水中的电离方程式书写正确的是( ) A.Al2(SO4)3?2Al3++3SO42? B.NaHCO3?Na++H++CO32? C.NaHSO4?Na++HSO4? D.KClO3?K++Cl?+3O2? |
|
| 14. | 详细信息 |
|
关于1mol/L K2SO4溶液的下列说法正确的是( ) A.溶液中含有1mol K2SO4 B.1mol K2SO4溶于1L水中 C.溶液中c(K+ )=2mol/L D.1L 溶液中含2mol K+ , 2mol SO42? |
|
| 15. | 详细信息 |
|
“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中一种.若将纳米碳均匀地分散到蒸馏水中,所形成的分散系:①是溶液 ②是胶体 ③能产生丁达尔效应 ④分散质粒子能透过滤纸 ⑤分散质粒子不能透过滤纸 ⑥静置后,会析出黑色沉淀( ) A.①④⑥ B.②③④ C.②③⑤ D.①⑤⑥ |
|
| 16. | 详细信息 |
|
下列关于氯水的叙述正确的是( ) A.新制氯水可使蓝色石蕊试纸先变红后褪色 B.光照氯水有气泡放出,该气体是Cl2 C.新制氯水中只含Cl2和H2O分子 D.氯水放置数天后酸性将变弱 |
|
| 17. | 详细信息 | |||||||||||||||
下列实验事实陈述ⅠⅡ正确并且有因果关系的是( )
|
||||||||||||||||
| 18. | 详细信息 |
|
核内中子数为N的R2+ , 质量数为A,则ngR2+所含电子的物质的量是( ) A. B. C. D. |
|
| 19. | 详细信息 |
|
2H、13C、15N、18O、34S等常用作环境分析指示物,下列对它们的说法正确的是( ) A.34S原子核内的中子数为16 B.16O与18O互称同位素 C.13C和15N原子核内的质子数相差2 D.2H的核外电子数比1H多一个 |
|
| 20. | 详细信息 |
|
在浓度均为3mol/L的盐酸和硫酸各100mL溶液中,分别加入等质量的铁粉,充分反应后生成气体质量之比为3:4.则加入铁粉的质量是( ) A.1.8 g B.11.2 g C.5.6 g D.8.4 g |
|
| 21. | 详细信息 |
|
质量分数为a%,物质的量浓度为c mol?L?1的NaCl溶液,蒸发溶剂,恢复到原来的温度,若物质的量浓度变为2c mol?L?1 , 则质量分数变为(蒸发过程中没有晶体析出,且NaCl溶液的密度大于1g/mL)( ) A.等于2a% B.大于2a% C.小于2a% D.无法确定 |
|
| 22. | 详细信息 |
|
标准状况下,a g气体A和b g气体B的体积相同,下列叙述正确的是( ) A.A和B的原子个数比是1:1 B.A和B的密度之比为b:a C.A和B的摩尔质量比是a:b D.A和B的分子数之比是b:a |
|
| 23. | 详细信息 | ||||||||||||
a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如表所示:
由上述现象可推知a、b、c、d依次是( ) |
|||||||||||||
| 24. | 详细信息 |
|
配制一定物质的量浓度溶液时,会导致所配溶液浓度偏大的操作是( ) A.在用蒸馏水洗涤烧杯时,洗液未全部注入容量瓶中 B.用量筒量取浓硫酸时,俯视刻度线 C.用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理 D.定容时俯视刻度线 |
|
| 25. | 详细信息 |
|
将标准状况下的a升氯化氢气体溶于1000克水中,得到的盐酸的密度为b克/毫升,则该盐酸的物质的量的浓度是( ) A. B. C. D. |
|
| 26. | 详细信息 |
|
今有七种物质:①铝线 ②熔化的KNO3③氯气 ④NaCl 晶体⑤液态氯化氢 ⑥石灰水 ⑦乙醇 (1)其中能导电的物质是 (2)属于电解质的是 (3)属于非电解质的是 . |
|
| 27. | 详细信息 |
|
已知A,B,C,D,E五种物质都含有相同的元素X,这五种物质间相互转化关系如下: 已知A是一种黄绿色气体,由此推断:  (1)这五种物质的化学式为: A: B: C D: E: (2)写出水溶液中发生下列化学反应的化学方程式: A→D: D→E: B→D: . |
|
| 28. | 详细信息 |
|
实验室用碳酸钠晶体(Na2CO3?10H2O)配制500mL 0.1mol/L Na2CO3溶液,回答下列问题: (1)不需要用到的仪器有 (填序号) A 托盘天平 B 试管 C烧杯 D 玻璃棒 E 分液漏斗 F 500mL容量瓶 G 药匙 H 250mL容量瓶 I 胶头滴管 (2)配制正确的操作顺序为 (填序号) A 计算:正确称量碳酸钠晶体的质量 B定容:用胶头滴管加水至刻度线,摇匀 C洗涤:用蒸馏水洗涤玻璃棒、烧杯2?3次,并将洗涤液转移至容量瓶中 D溶解:将称量的碳酸钠晶体放入烧杯中,再加适量的水并用玻璃棒搅拌 E转移:将冷却至室温的碳酸钠溶液,沿玻璃棒转入容量瓶中,摇匀 (3)下列操作,会使得配制的结果偏小的是 (填写编号). A 称量时碳酸钠晶体与砝码的位置颠倒 B 使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度 C 没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中 D 容量瓶刚用蒸馏水洗净,没有烘干 E 定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切. |
|
| 29. | 详细信息 |
如图1是某研究性学习小组设计制取氯气并以氯气为原料进行特定反应的装置. (1)要将C装置接入B和D之间,正确的接法是:a→ → →d; (2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯,Cl2通过C装置后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为 . (3)D处反应完毕后,关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是 , B的作用是 . (4)用量筒量取20mL E中溶液,倒入已检查完气密性良好的分液漏斗中,然后再注入10mL CCl4 , 盖好玻璃塞,振荡,静置于铁架台上(如图2),等分层后取上层液和下层液,能使有色布条褪色的是 (填“上层液”或“下层液”). |
|
最近更新



