2017-2018年高一上学期期末化学试卷(黑龙江省大庆中学)
| 1. | 详细信息 |
|
检验某未知溶液中是否含有SO42-,下列操作最合理的是( ) A. 加入HNO3酸化的Ba(NO3)2溶液 B. 先加HNO3酸化,再加Ba(NO3)2溶液 C. 加入盐酸酸化的BaCl2 D. 先用盐酸酸化,若有沉淀产生,则过滤,滤液中再加BaCl2溶液 |
|
| 2. | 详细信息 |
|
除去镁粉中的少量铝粉,可选用( ) A. 硫酸 B. 氨水 C. 盐酸 D. 氢氧化钠溶液 |
|
| 3. | 详细信息 |
|
某无色溶液放入铝片后有氢气产生,在该溶液中下列离子一定可以大量存在的是( ) A. HCO C. Cl- D. CO32- |
|
| 4. | 详细信息 |
|
下列离子方程式正确的是( ) A. 将氨水滴入到FeCl3溶液中:Fe3++3OH-===Fe(OH)3↓ B. 向氯化亚铁溶液中通入Cl2:Fe2++Cl2===Fe3++2Cl- C. 向FeCl3溶液中加入铁粉:Fe+Fe3+===2Fe2+ D. 氧化铁与盐酸反应:Fe2O3+6H+===2Fe3++3H2O |
|
| 5. | 详细信息 |
|
将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液,没有颜色变化,再加氯水即呈现红色的是( ) A. FeO B. Fe2O3 C. Fe3O4 D. Fe2(SO4)3 |
|
| 6. | 详细信息 |
|
下列关于物质用途的说法中,不正确的是( ) A. 硅酸钠可用于制备硅胶和木材防火剂等 B. 氧化铝熔点高可用作耐火材料 C. 晶体硅可用于制造光导纤维 D. 漂白粉和臭氧可用于自来水消毒 |
|
| 7. | 详细信息 |
|
为了防止食品受潮及富脂食品氧化变质,在食品包装袋中应放入的化学物质是( ) A. 无水硫酸铜和蔗糖 B. 硅胶和硫酸亚铁 C. 食盐和硫酸亚铁 D. 生石灰和食盐 |
|
| 8. | 详细信息 |
|
将30 mL 0.5mol/L的NaOH溶液加水稀释到500 mL,稀释后NaOH的物质的量浓度为? ( ) A. 0.3 mol/L B. 0.03 mol/L C. 0.05 mol/L D. 0.04 mol/L |
|
| 9. | 详细信息 |
|
已知14.2g气体G在标准状况下的体积是4.48L,则气体G的摩尔质量是(? ) A. 28.4 B. 28.4g/mol C. 71 D. 71g/mol |
|
| 10. | 详细信息 |
|
下列配制的溶液浓度偏高的是 A.配制盐酸溶液用量筒量取盐酸时俯视刻度线 B.配制盐酸溶液定容时,仰视容量瓶刻度线 C.称量40gNaOH 配制1 mol/L NaOH溶液1000mL时,砝码错放左盘 D.H2SO4稀释后未经冷却即注入容量瓶配制 |
|
| 11. | 详细信息 |
|
关于Na2CO3和NaHCO3性质的说法不正确的是 A.热稳定性:NaHCO3<Na2CO3 B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3 C. 相同温度时,在水中的溶解性:NaHCO3<Na2CO3 D. 等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2质量相同 |
|
| 12. | 详细信息 |
|
除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是( ) A. 通入二氧化碳气体 B. 加入氢氧化钡溶液 C. 加入澄清石灰水 D. 加入稀盐酸 |
|
| 13. | 详细信息 |
|
节日焰火表演,精彩纷呈,让人惊叹不已。下列关于焰色反应的说法正确的是( ) A. 焰色反应是金属化合物的性质 B. NaCl与Na2CO3灼烧时火焰颜色相同 C. 焰色反应均应透过蓝色钴玻璃观察 D. 所有金属及其化合物灼烧时火焰均有颜色 |
|
| 14. | 详细信息 |
|
下列氧化还原反应中,水作为氧化剂的是( ) A. C+H2O(g) C. 2Na2O2+2H2O===4NaOH+O2↑ D. 2F2+2H2O===4HF+O2 |
|
| 15. | 详细信息 |
|
下列说法正确的是( ) A. 摩尔是七个基本物理量之一 B. 1molH2SO4中含有阿伏伽德罗常数个氢原子 C. 1个氧气分子的质量约为32/NA g D. 硫酸根离子的摩尔质量是96 g |
|
| 16. | 详细信息 |
|
将一小块钠投入下列溶液中,既能产生气体又会出现白色沉淀的是( ) A. 氯化镁溶液 B. 稀H2SO4 C. 稀氢氧化钠溶液 D. 硫酸铜溶液 |
|
| 17. | 详细信息 |
|
将1.95g由Na2SO4和Na2CO3组成的混合物溶于水得溶液A,在A中加入10mL未知的BaCl2溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀盐酸,充分反应后剩余沉淀2.33g。计算: (1)原混合物中Na2CO3的质量分数___________ (2)BaCl2溶液的物质的量浓度_____________ |
|
| 18. | 详细信息 |
|
A、B、C是单质,其中A是金属,各种物质间的转化关系如图: 根据图示转化关系回答:  (1)写出下列物质的化学式。 A________,B________,甲_________,乙________。 (2)写出下列变化的化学方程式。 ①A与NaOH溶液反应的化学方程式________________________________。 ②甲与NaOH溶液反应的离子方程式________________________________。 (3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。 |
|
| 19. | 详细信息 |
Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如下图所示装置进行有关实验。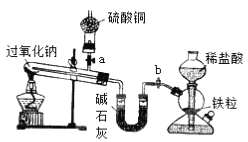 (1)此装置中,怎样检查除启普发生器之外的装置的气密性?_________________________________。 (2)请完成该实验的有关操作步骤。 ①检查装置气密性; ②打开a、b产生氢气,观察试管内物质的颜色变化; ③____________________________________________________; ④加热过氧化钠,观察试管内物质的颜色变化; ⑤反应完全后,__________________________________________; ⑥拆卸装置。 (3)该装置中,碱石灰的作用是_________________________ 。 (4)实验过程中观察到(2)中步骤②无明显变化,步骤④Na2O2熔化后,黄色粉末立即变成白色,干燥管内硫酸铜未变成蓝色。则Na2O2与H2反应的化学方程式为_________。 |
|
最近更新



