жІіеҢ—зңҒжІ§е·һеёӮжҷ®йҖҡй«ҳдёӯй«ҳдёүдёҠеӯҰжңҹж•ҷеӯҰиҙЁйҮҸзӣ‘жөӢеҢ–еӯҰиҖғиҜ•йўҳ
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰдёҺзӨҫдјҡгҖҒз”ҹжҙ»еҜҶеҲҮзӣёе…іпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. ж°ўж°§еҢ–й“қгҖҒзўій…ёй’ еёёз”ЁдҪңиғғй…ёдёӯе’ҢеүӮ B. иҡ•дёқе’ҢдәәйҖ дёқе……еҲҶж°ҙи§ЈеҗҺеқҮеҸҜеҫ—еҲ°ж°Ёеҹәй…ё C. йЈҹзӣҗеҸҜдҪңи°ғе‘іеүӮ,д№ҹеҸҜдҪңйЈҹе“ҒйҳІи…җеүӮ D. з”Ёжө“зЎ«й…ёеҲ»иҡҖзҹіиӢұжқҗж–ҷеҲ¶дҪңиүәжңҜе“Ғ |
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
жқҺж—¶зҸҚеңЁгҖҠжң¬иҚүзәІзӣ®гҖӢдёӯеҶҷеҲ°:вҖңзғ§й…’йқһеҸӨжі•д№ҹпјҢзҷҪе…ғж—¶е§ӢеҲӣе…¶жі•гҖӮз”Ёжө“й…’е’Ңзіҹе…Ҙз”‘пјҢи’ёд»Өж°”дёҠ,з”ЁеҷЁжүҝеҸ–ж»ҙйңІгҖӮвҖқж–Үдёӯж¶үеҸҠзҡ„ж“ҚдҪңж–№жі•жҳҜ A. и’ёйҰҸ B. еҚҮеҚҺ C. иҗғеҸ– D. е№ІйҰҸ |
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
е·ІзҹҘеҸҚеә”X(g)+3Y(g) A. в–іH= E2- E1 B. жӣҙжҚўй«ҳж•ҲеӮ¬еҢ–еүӮ,E3дёҚеҸҳ C. жҒ’еҺӢдёӢе……е…ҘдёҖе®ҡйҮҸзҡ„ж°Ұж°”n(Z)еҮҸе°‘ D. еҺӢзј©е®№еҷЁпјҢc(X)еҮҸе°Ҹ |
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—дәӢе®һиғҪиҜҒжҳҺHCOOHдёәејұй…ёзҡ„жҳҜ A. еҸҜдёҺNa2CO3еҸҚеә”з”ҹжҲҗCO2 B. еёёжё©ж—¶HCOONaжә¶ж¶Ізҡ„pHеӨ§дәҺ7 C. еҜјз”өиғҪеҠӣдҪҺдәҺеҗҢжө“еәҰзҡ„зЎ«й…ё D. 0.1mol/LHCOOHжә¶ж¶ІеҸҜд»ҘдҪҝз”Іеҹәж©ҷеҸҳзәў |
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺжңүжңәеҢ–еҗҲзү©иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. жңүжңәзү© B. д№ҷй…ёд№ҷй…ҜеңЁзўұжҖ§жқЎд»¶дёӢзҡ„ж°ҙи§ЈеҸҚеә”з§°дёәзҡӮеҢ–еҸҚеә” C. жңүжңәзү© D. д№ҷйҶӣе’ҢдёҷзғҜйҶӣ( |
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖј,дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A. 30gд№ҷзғ·дёӯжүҖеҗ«зҡ„жһҒжҖ§е…ұд»·й”®ж•°зӣ®дёә7NA B. 1molSO2дёҺи¶ійҮҸ02еҸҚеә”з”ҹжҲҗSO3еҲҶеӯҗж•°зӣ®дёәNA C. ж ҮеҮҶзҠ¶еҶөдёӢ22.4LCHCl3дёӯеҗ«жңүзҡ„ClеҺҹеӯҗж•°зӣ®дёә3NA D. 1.0LO.1mol/Lзҡ„NaClOжә¶ж¶Ідёӯеҗ«жңүзҡ„ClO-ж•°зӣ®е°ҸдәҺ0.1NA |
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
еҲҶеӯҗејҸдёәC10Hl2O2,иғҪдёҺNaHCO3жә¶ж¶ІеҸҚеә”ж”ҫеҮәCO2,дё”зұізҺҜдёҠдёҖж°Ҝд»Јзү©жңүдёӨз§Қзҡ„жңүжңәзү©жңү(дёҚиҖғиҷ‘з«ӢдҪ“ејӮжһ„) A. 7з§Қ B. 9з§Қ C. 11з§Қ D. 12з§Қ |
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
дә”з§Қеёёи§Ғзү©иҙЁзҡ„иҪ¬еҢ–е…ізі»еҰӮеӣҫжүҖзӨә(йғЁеҲҶеҸҚеә”зү©еҸҠдә§зү©з•ҘеҺ»),е…¶дёӯQгҖҒMгҖҒNеҗ«жңүжҹҗз§ҚзӣёеҗҢзҡ„е…ғзҙ гҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ A. иӢҘQдёәN2пјҢеҲҷXеҸҜиғҪдёәж°ўж°” B. иӢҘQдёәA1(OH)3пјҢеҲҷYеҸҜиғҪдёәзЁҖзЎ«й…ё C. иӢҘQдёәFe,еҲҷYеҸҜиғҪдёәзЁҖзЎқй…ё D. иӢҘQдёәNaHCO3пјҢеҲҷXеҸҜиғҪдёәж°ўж°§еҢ–й’ жә¶ж¶І |
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
еҗ‘еҒҸй“қй…ёй’ жә¶ж¶ІдёӯйҖҗж»ҙеҠ е…Ҙзӣҗй…ё,жә¶иў«зҡ„pHеҖјйҡҸзқҖеҠ е…Ҙзӣҗй…ёдҪ“з§Ҝзҡ„еҸҳеҢ–жӣІзәҝеҰӮеӣҫжүҖзӨәпјҢеҲҷдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ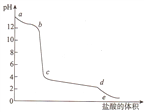 A. aпҪһbж®өзҡ„дё»иҰҒзҰ»еӯҗж–№зЁӢејҸдёәA102-+4H+=Al3++2H2O B. еҗ‘cзӮ№жә¶ж¶Ідёӯж»ҙеҠ ж°Ёж°ҙ,еҸ‘з”ҹзҡ„зҰ»еӯҗж–№зЁӢејҸдёәA13++30H-=Al(OH)3вҶ“ C. cпҪһdж®өзҡ„дё»иҰҒзҰ»еӯҗж–№зЁӢејҸдёәAl(OH)3+3H+= A13++3H2O D. еҗ‘cзӮ№жә¶ж¶ІдёӯеҠ е…Ҙзўій…ёй’ пјҢеҸ‘з”ҹзҡ„зҰ»еӯҗж–№зЁӢејҸдёә2 A13++CO32-+3H2O =2Al(OH)3вҶ“+CO2вҶ‘ |
|
| 10. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
дёӢеҲ—е®һйӘҢж“ҚдҪңгҖҒзҺ°иұЎе’Ңз»“и®әеқҮжӯЈзЎ®зҡ„жҳҜ
|
|||||||||||||||||||||
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
еүҚ20еҸ·дё»ж—Ҹе…ғзҙ WгҖҒXгҖҒYгҖҒZзҡ„еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§гҖӮWзҡ„еҺҹеӯҗжңҖеӨ–еұӮз”өеӯҗж•°жҳҜж¬ЎеӨ–еұӮз”өеӯҗж•°зҡ„3еҖҚгҖӮXгҖҒYгҖҒZеҲҶеұһдёҚеҗҢзҡ„е‘ЁжңҹпјҢе®ғ们зҡ„еҺҹеӯҗеәҸж•°д№Ӣе’ҢжҳҜWеҺҹеӯҗеәҸж•°зҡ„5еҖҚгҖӮеҗ«жңүе…ғзҙ Zзҡ„зӣҗзҡ„з„°иүІеҸҚеә”дёәзҙ«иүІгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. еҺҹеӯҗеҚҠеҫ„зҡ„еӨ§е°ҸW B. з®ҖеҚ•ж°ўеҢ–зү©зҡ„зғӯзЁіе®ҡжҖ§W>X C. XгҖҒYзҡ„з®ҖеҚ•зҰ»еӯҗе…·жңүзӣёеҗҢзҡ„з”өеӯҗеұӮз»“жһ„ D. е·ҘдёҡдёҠйҖҡиҝҮз”өи§ЈWгҖҒYз»„жҲҗзҡ„еҢ–еҗҲзү©еҲ¶еӨҮеҚ•иҙЁY |
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗз§‘з ”е°Ҹз»„еҲ©з”ЁеҰӮдёӢеҸҚеә”ж¶ҲйҷӨNOе’ҢCOзҡ„жұЎжҹ“;2NO(g)+2CO(g) A. x<0 B. Оұ(NO)=80% C. 0пҪһ5minеҶ…пјҢV(CO)=0.16mol/(L?min) D. дҝқжҢҒжё©еәҰдёҚеҸҳпјҢиӢҘеҶҚеҗ‘дёҠиҝ°е№іиЎЎдҪ“зі»дёӯе……е…Ҙ2molNOе’Ң2molCOпјҢйҮҚж–°иҫҫе№іиЎЎж—¶пјҢc(N2)=0.8mol/L |
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
е·ІзҹҘp(A)=-lgc(A)гҖӮдёүз§ҚйҮ‘еұһзЎ«еҢ–зү©еңЁж°ҙдёӯзҡ„жІүж·Җжә¶и§Је№іиЎЎжӣІзәҝеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ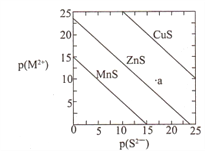 A. aзӮ№ж— ZnSжІүж·Җз”ҹжҲҗ B. еҸҜз”ЁMnSйҷӨеҺ»MnCl2жә¶ж¶Ідёӯж··жңүзҡ„е°‘йҮҸZnCl2 C. еҗ‘CuSжӮ¬жөҠж¶ІдёӯеҠ е…Ҙе°‘йҮҸж°ҙ,е№іиЎЎеҗ‘жә¶и§Јзҡ„ж–№еҗ‘移еҠЁпјҢc(S2-)еўһеӨ§ D. CuSе’ҢMnSе…ұеӯҳзҡ„жӮ¬зӢ¬ж¶ІдёӯпјҢ |
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
д»Ҙй“…и“„з”өжұ дёәз”өжәҗ.йҖҡиҝҮз”өи§Јжі•еҲ¶еӨҮй…’зҹій…ё(C4H606,з®ҖеҶҷдёәRH2)зҡ„еҺҹзҗҶеҰӮеӣҫжүҖзӨә(AгҖҒBдёәжғ°жҖ§з”өжһҒ,aгҖҒbдёәзҰ»еӯҗдәӨжҚўиҶң) дёӢеҲ—еҸҷиҝ°дёҚжӯЈзЎ®зҡ„жҳҜ A. NжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёәPbO2+2e-+SO42-+4H+=PbSO4+2H2O B. bдёәйҳҙзҰ»еӯҗдәӨжҚўиҶң C. йҳҙжһҒеҸҚеә”дёә2H20+2e-=H2вҶ‘+20H-пјҢйҳҙжһҒеҢәжә¶ж¶ІpHеҚҮй«ҳ D. й“…и“„з”өжұ дёӯж¶ҲиҖ—2molH2SO4ж—¶пјҢзҗҶи®әдёҠз”ҹжҲҗ2molRH2 |
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
дёәйӘҢиҜҒиҝҳеҺҹжҖ§:SO2>Fe2+>C1-пјҢдёүз»„еҗҢеӯҰеҲҶеҲ«иҝӣиЎҢдәҶдёӢеӣҫе®һйӘҢпјҢ并еҜ№жә¶ж¶І1е’Ңжә¶ж¶І2дёӯжүҖеҗ«зҰ»еӯҗиҝӣиЎҢдәҶжЈҖйӘҢ,иғҪиҜҒжҳҺдёҠиҝ°иҝҳеҺҹжҖ§йЎәеәҸзҡ„е®һйӘҢз»„жңү A. еҸӘжңүз”І B. з”ІгҖҒд№ҷ C. з”ІгҖҒдёҷ D. з”ІгҖҒд№ҷгҖҒдёҷ |
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
еёёжё©дёӢ,е°ҶHC1ж°”дҪ“йҖҡе…ҘеҲ°1Lжө“еәҰеқҮдёә0.1mol/Lзҡ„NaAе’ҢNaBзҡ„ж··еҗҲжә¶ж¶ІдёӯпјҢж··еҗҲжә¶ж¶Ізҡ„pHдёҺзҰ»еӯҗжө“еәҰеҸҳеҢ–зҡ„е…ізі»еҰӮеӣҫжүҖзӨә(еҝҪз•Ҙжә¶ж¶ІдҪ“з§Ҝзҡ„еҸҳеҢ–)гҖӮдёӢеҲ—еҸҷиҝ°дёҚжӯЈзЎ®зҡ„жҳҜ A. Ka(HB)зҡ„ж•°йҮҸзә§дёә10-9 B. й…ёжҖ§зҡ„ејәејұйЎәеәҸдёәHCl>HA>HB C. еҪ“йҖҡе…Ҙ0.1molHC1ж°”дҪ“ж—¶пјҢc(B-)>c(A-) D. еҪ“ж··еҗҲжә¶ж¶Іе‘ҲдёӯжҖ§ж—¶,c(Na+)=c(Cl-)+c(A-)+c(B-) |
|
| 17. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||||||||||||
е®һйӘҢе®ӨеҲ¶еӨҮиӢҜз”Ій…ёд№ҷй…Ҝзҡ„еҸҚеә”иЈ…зҪ®зӨәж„Ҹеӣҫе’Ңжңүе…іж•°жҚ®еҰӮдёӢпјҡ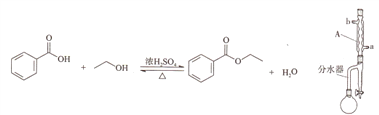
|
||||||||||||||||||||||||||
| 18. | иҜҰз»ҶдҝЎжҒҜ |
зўІ(Te)дёә第VIAе…ғзҙ пјҢе…¶еҚ•иҙЁеҮӯеҖҹдјҳиүҜзҡ„жҖ§иғҪжҲҗдёәеҲ¶дҪңеҗҲйҮ‘ж·»еҠ еүӮгҖҒеҚҠеҜјдҪ“гҖҒе…үз”өе…ғ件зҡ„дё»дҪ“жқҗж–ҷпјҢ并被е№ҝжіӣеә”з”ЁдәҺеҶ¶йҮ‘гҖҒиҲӘз©әиҲӘеӨ©гҖҒз”өеӯҗзӯүйўҶеҹҹгҖӮеҸҜд»ҺзІҫзӮјй“ңзҡ„йҳіжһҒжіҘ(дё»иҰҒжҲҗеҲҶдёәCu2Te)дёӯеӣһ收碲пјҢе·ҘиүәжөҒзЁӢеҰӮдёӢ : (1)вҖңз„ҷзғ§вҖқеҗҺ,зўІдё»иҰҒд»ҘTeO2 еҪўејҸеӯҳеңЁ,еҶҷеҮәзӣёеә”еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ:_____________гҖӮ (2)дёәдәҶйҖүжӢ©жңҖдҪізҡ„з„ҷзғ§е·Ҙиүә,иҝӣиЎҢдәҶжё©еәҰе’ҢзЎ«й…ёеҠ е…ҘйҮҸзҡ„жқЎд»¶иҜ•йӘҢпјҢз»“жһңеҰӮдёӢиЎЁжүҖзӨә:  еҲҷе®һйӘҢдёӯеә”йҖүжӢ©зҡ„жқЎд»¶дёә_______________пјҢеҺҹеӣ дёә_______________гҖӮ (3)е·Ҙиүә( I)дёӯпјҢвҖңиҝҳеҺҹвҖқж—¶еҸ‘з”ҹзҡ„жҖ»зҡ„еҢ–еӯҰж–№зЁӢејҸдёә_______________гҖӮ (4)з”ұдәҺе·Ҙиүә(I)дёӯвҖңж°§еҢ–вҖқеҜ№жә¶ж¶Іе’Ңзү©ж–ҷжқЎд»¶иҰҒжұӮй«ҳпјҢжңүз ”з©¶иҖ…йҮҮз”Ёе·Ҙиүә(II)иҺ·еҫ—зўІгҖӮеҲҷвҖңз”өз§ҜвҖқиҝҮзЁӢдёӯпјҢйҳҙжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёә_______________гҖӮ (5)е·Ҙдёҡз”ҹдә§дёӯпјҢж»ӨжёЈ2з»ҸзЎ«й…ёй…ёжөёеҗҺеҫ—ж»Өж¶І3е’Ңж»ӨжёЈ3гҖӮ в‘ ж»Өж¶І3 дёҺж»Өж¶І1еҗҲ并пјҢиҝӣе…Ҙй“ңз”өз§Ҝзі»з»ҹгҖӮиҜҘеӨ„зҗҶжҺӘж–Ҫзҡ„дјҳзӮ№дёә________________гҖӮ в‘Ўж»ӨжёЈ3дёӯиӢҘеҗ«Auе’ҢAg,еҸҜз”Ё__________е°ҶдәҢиҖ…еҲҶзҰ»гҖӮ(еЎ«еӯ—жҜҚ) A.зҺӢж°ҙ B.зЁҖзЎқй…ё C.жө“ж°ўж°§еҢ–й’ жә¶ж¶І D.жө“зӣҗй…ё |
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ІйҶӣ(HCHO)дҝ—з§°иҡҒйҶӣ,жҳҜдёҖз§ҚйҮҚиҰҒзҡ„жңүжңәеҺҹж–ҷгҖӮ I.еҲ©з”Ёз”ІйҶҮ(CH3OH)еҲ¶еӨҮз”ІйҶӣ и„ұж°ўжі•:CH3OH(g)=HCHO(g)+H2(g) в–іH1 = +92.09kJ/mol ж°§еҢ–жі•:CH3OH(g) +1/2O2(g)=HCHO(g)+H2O(g) в–іH2 (1)е·ІзҹҘ:2H2(g)+O2(g)=2H2O(g) в–іH3=-483.64 kJ/molпјҢеҲҷв–іH2=_______гҖӮ (2)дёҺи„ұж°ўжі•зӣёжҜ”,ж°§еҢ–жі•еңЁзғӯеҠӣеӯҰдёҠи¶ӢеҠҝиҫғеӨ§пјҢе…¶еҺҹеӣ дёә_______________гҖӮ (3)еӣҫ1дёәз”ІйҶҮеҲ¶еӨҮз”ІйҶӣеҸҚеә”зҡ„lg K(Kдёәе№іиЎЎеёёж•°)йҡҸжё©еәҰ(T)зҡ„еҸҳеҢ–жӣІзәҝгҖӮжӣІзәҝ____(еЎ«вҖңaвҖқжҲ–вҖңbвҖқ)еҜ№еә”и„ұж°ўжі•,еҲӨж–ӯдҫқжҚ®дёә_________________гҖӮ  II.з”ІйҶӣзҡ„з”ЁйҖ” (4)е°Ҷз”ІйҶӣж°ҙжә¶ж¶ІдёҺж°Ёж°ҙж··еҗҲи’ёеҸ‘еҸҜеҲ¶еҫ—д№Ңжҙӣжүҳе“Ғ(з»“жһ„з®ҖејҸеҰӮеӣҫ2)пјҢиҜҘзү©иҙЁеңЁеҢ»иҚҜзӯүе·Ҙдёҡдёӯжңүе№ҝжіӣз”ЁйҖ”гҖӮиӢҘеҺҹж–ҷе®Ңе…ЁеҸҚеә”з”ҹжҲҗд№Ңжҙӣжүҳе“Ғ,еҲҷз”ІйҶӣдёҺж°Ёзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә_______гҖӮ (5)е°Ҷз”ІйҶӣж°ҙжә¶ж¶ІдёҺзЎ«й…ёй•Қ(NiSO4)ж··еҗҲпјҢеҸҜз”ЁдәҺеҢ–еӯҰй•Җй•ҚгҖӮиӢҘеҸҚеә”иҝҮзЁӢдёӯжңүCO2дә§з”ҹпјҢеҲҷиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә____________________гҖӮ в…ў.з”ІйҶӣзҡ„жЈҖжөӢ (6)е®ӨеҶ…з”ІйҶӣи¶…ж ҮдјҡеҚұе®ідәәдҪ“еҒҘеә·пјҢйҖҡиҝҮдј ж„ҹеҷЁеҸҜд»Ҙзӣ‘жөӢз©әж°”дёӯз”ІйҶӣзҡ„еҗ«йҮҸгҖӮдёҖз§ҚзҮғж–ҷз”өжұ еһӢз”ІйҶӣж°”дҪ“дј ж„ҹеҷЁзҡ„еҺҹзҗҶеҰӮеӣҫ3жүҖзӨәпјҢеҲҷbжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёә_________пјҢеҪ“з”өи·ҜдёӯиҪ¬з§»4Г—10-4 molз”өеӯҗж—¶пјҢдј ж„ҹеҷЁеҶ…еҸӮеҠ еҸҚеә”зҡ„HCHOдёә_______mgгҖӮ |
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
гҖҗйҖүдҝ®3:зү©иҙЁз»“жһ„дёҺжҖ§иҙЁгҖ‘й“ңе…ғзҙ еҸҜеҪўжҲҗеӨҡз§ҚйҮҚиҰҒеҢ–еҗҲзү©гҖӮеӣһзӯ”дёӢеҲ—й—®йўҳ: (1)й“ңе…ғзҙ дҪҚдәҺе…ғзҙ е‘ЁжңҹиЎЁдёӯзҡ„_____еҢә,е…¶еҹәжҖҒеҺҹеӯҗзҡ„д»·з”өеӯҗжҺ’еёғеӣҫдёә_________гҖӮ (2)еҫҖзЎ«й…ёй“ңжә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙ,еҸҜеҪўжҲҗ[Cu(NH3)4]SO4жә¶ж¶І,иҜҘжә¶ж¶ІеҸҜз”ЁдәҺжә¶и§ЈзәӨз»ҙзҙ гҖӮ в‘ [Cu(NH3)4]SO4дёӯйҳҙзҰ»еӯҗзҡ„з«ӢдҪ“жһ„еһӢжҳҜ__________гҖӮ в‘ЎеңЁ[Cu(NH3)4]SO4дёӯ,Cu2+дёҺNH3 д№Ӣй—ҙеҪўжҲҗзҡ„еҢ–еӯҰй”®з§°дёә______пјҢжҸҗдҫӣеӯӨз”өеӯҗеҜ№зҡ„жҲҗй”®еҺҹеӯҗжҳҜ_________гҖӮ в‘ўйҷӨзЎ«е…ғзҙ еӨ–пјҢ[Cu(NH3)4]SO4дёӯжүҖеҗ«е…ғзҙ зҡ„з”өиҙҹжҖ§з”ұе°ҸеҲ°еӨ§зҡ„йЎәеәҸдёә________гҖӮ в‘ЈNF3дёҺNH3 зҡ„з©әй—ҙжһ„еһӢзӣёеҗҢпјҢдёӯеҝғеҺҹеӯҗзҡ„иҪЁйҒ“жқӮеҢ–зұ»еһӢеқҮдёә_________гҖӮдҪҶNF3дёҚжҳ“дёҺCu2+еҪўжҲҗеҢ–еӯҰй”®пјҢе…¶еҺҹеӣ жҳҜ_______________гҖӮ (3)дёҖз§ҚHg-Ba-Cu-Oй«ҳжё©и¶…еҜјжқҗж–ҷзҡ„жҷ¶иғһ(й•ҝж–№дҪ“)еҰӮеӣҫжүҖзӨәгҖӮ  в‘ иҜҘзү©иҙЁзҡ„еҢ–еӯҰејҸдёә__________гҖӮ в‘Ўе·ІзҹҘиҜҘжҷ¶иғһдёӯдёӨдёӘBa2+зҡ„й—ҙи·қдёәc pm.еҲҷи·қзҰ»Ba2+жңҖиҝ‘зҡ„Hg+ж•°зӣ®дёә_____дёӘпјҢдәҢиҖ…зҡ„жңҖзҹӯи·қзҰ»дёә_______pmгҖӮ(еҲ—еҮәи®Ўз®—ејҸеҚіеҸҜпјҢдёӢеҗҢ) в‘ўи®ҫиҜҘзү©иҙЁзҡ„ж‘©е°”иҙЁйҮҸдёәM,йҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјдёәNAпјҢеҲҷиҜҘжҷ¶дҪ“зҡ„еҜҶеәҰдёә______g?cm-3гҖӮ |
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
дёӢйқўжҳҜд»Ҙжңүжңәзү©AеҗҲжҲҗиҒҡй…Ҝзұ»й«ҳеҲҶеӯҗеҢ–еҗҲзү©Fзҡ„и·Ҝзәҝ: е·ІзҹҘ:  еӣһзӯ”дёӢеҲ—й—®йўҳ: пјҲ1пјүAз”ҹжҲҗBзҡ„еҸҚеә”зұ»еһӢдёә_____пјҢCдёӯзҡ„е®ҳиғҪеӣўеҗҚз§°дёә________гҖӮ пјҲ2пјүDдёҺNaOHж°ҙжә¶ж¶ІеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә________гҖӮ пјҲ3пјүв‘ Eз”ҹжҲҗFзҡ„еҢ–еӯҰж–№зЁӢејҸдёә________гҖӮ в‘ЎиӢҘFзҡ„е№іеқҮзӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёә20000пјҢеҲҷе…¶е№іеқҮиҒҡеҗҲеәҰдёә________гҖӮ(еЎ«еӯ—жҜҚ) AпјҺ54 BпјҺ108? CпјҺ119? DпјҺ133 пјҲ4пјүEеңЁдёҖе®ҡжқЎд»¶дёӢиҝҳеҸҜд»ҘеҗҲжҲҗеҗ«жңүе…ӯе…ғзҺҜзҠ¶з»“жһ„зҡ„GгҖӮGзҡ„з»“жһ„з®ҖејҸдёә________гҖӮ пјҲ5пјүж»Ўи¶ідёӢеҲ—жқЎд»¶зҡ„Cзҡ„еҗҢеҲҶејӮжһ„дҪ“жңү_____з§ҚгҖӮ(дёҚиҖғиҷ‘з«ӢдҪ“ејӮжһ„) в‘ еҗ«жңү1дёӘе…ӯе…ғзўізҺҜдё”зҺҜдёҠзӣёйӮ»4дёӘзўіеҺҹеӯҗдёҠеҗ„иҝһжңүдёҖдёӘеҸ–д»Јеҹә в‘Ў1molиҜҘзү©иҙЁдёҺж–җжһ—иҜ•еүӮеҸҚеә”дә§з”ҹ2molз –зәўиүІжІүж·Җ пјҲ6пјүеҶҷеҮәз”Ё  зҡ„еҗҲжҲҗи·Ҝзәҝ______гҖӮ(е…¶д»–иҜ•еүӮд»»йҖү) зҡ„еҗҲжҲҗи·Ҝзәҝ______гҖӮ(е…¶д»–иҜ•еүӮд»»йҖү) |
|
- зҰҸе»ә2018е№ҙй«ҳдёҖеҢ–еӯҰеүҚеҚҠжңҹжңҲиҖғжөӢйӘҢе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- 2019-2020е№ҙй«ҳдёҖдёӢжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҖғйўҳпјҲй»‘йҫҷжұҹзңҒе“Ҳе°”ж»ЁеёӮе®ҫеҺҝ第дәҢдёӯеӯҰпјү
- 2019зүҲеҝ…дҝ®з¬¬дәҢеҶҢ-е…Ёд№Ұз»јеҗҲжөӢиҜ„пјҲй«ҳдёӯеҢ–еӯҰиӢҸж•ҷпјү
- 2018-2019е№ҙй«ҳдәҢдёҠеҶҢиҒ”иҖғеҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲжұҹиҘҝзңҒеҗүе®үеёӮеҮ жүҖйҮҚзӮ№дёӯеӯҰпјү
- иӢҚжәӘе®һйӘҢдёӯеӯҰж ЎеңЁзәҝеҒҡйўҳ
- иҫҪе®ҒзңҒиҫҪ河油田第дәҢй«ҳзә§дёӯеӯҰ2020еұҠй«ҳдёү12жңҲиҖғиҜ•еҢ–еӯҰиҜ•еҚ·е®Ңж•ҙзүҲ
- жІіеҢ—2019е№ҙй«ҳдёҖеҢ–еӯҰеҗҺеҚҠжңҹжңҲиҖғжөӢйӘҢе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- 2018е№ҙиҮі2019е№ҙй«ҳдёҖдёӢеҶҢ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲе®үеҫҪзңҒиҡҢеҹ 第дәҢдёӯеӯҰпјү



