2017-2018年高三前半期化学期中考试考试题(吉林省白山市抚松五中、长白山实验中学、长白山二中、长白山实验中学联考)
| 1. | 详细信息 | |||||||||||||||
有些古文或谚语包含了丰富的化学知识,下列解释不正确的是( )
|
||||||||||||||||
| 2. | 详细信息 | |||||||||||||||||||||||||
下列物质分类的正确组合是( )
|
||||||||||||||||||||||||||
| 3. | 详细信息 |
|
用NA表示阿伏伽德罗常数,下列有关叙述错误的是( ) A.臭氧与氧气的混合气体4.8g中所含有的原子总数为0.3NA B.标准状况下,2.24L单质气体中含有原子数为0.2NA C.在常温常压下,3.4gNH3含有的电子数是2NA D.含5.4 gAl3+的硫酸铝溶液中,含有的SO42?的数目是0.3NA |
|
| 4. | 详细信息 |
|
下列说法错误的是( ) A.硅太阳能电池、计算机芯片、光导纤维都用到硅单质 B.水晶镜片、石英钟表、玛瑙手镯含有SiO2 C.水泥路桥、门窗玻璃、砖瓦、陶瓷餐具所用材料为硅酸盐 D.熔融烧碱时不能使用普通玻璃坩埚、石英坩埚和陶瓷坩埚 |
|
| 5. | 详细信息 |
化学概念在逻辑上存在如下关系: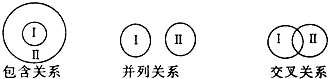 对下列概念的说法正确的是( ) A.电解质与非电解质属于包含关系 B.化合物与碱性氧化物属于包含关系 C.单质与化合物属于交叉关系 D.氧化还原反应与分解反应属于并列关系 |
|
| 6. | 详细信息 |
|
关于胶体,下列说法正确的是( ) A.胶体的聚沉是化学变化 B.含有0.01mol FeCl3的溶液制成的胶体中,胶体粒子的数目约为6.02×1021个 C.胶体的介稳性与胶体带有电荷有关 D.NaCl晶体既可制成溶液又可制成胶体 |
|
| 7. | 详细信息 |
|
在下列各组离子中,能大量共存的( ) A.Ag+、NO3?、Na+、Cl? B.K+、HCO3?、Cl?、Al3+ C.NO3?、Fe2+、H+、Br? D.K+、Cl?、SO42?、NH4+ |
|
| 8. | 详细信息 |
|
下列离子方程式正确的是( ) A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合NH4++Al3++2SO42?+2Ba2++4OH2BaSO4↓+Al(OH)3↓+NH3?H2O B.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2?2Fe3++2H2O C.用CH3COOH溶解CaCO3:CaCO3+2H+?Ca2++H2O+CO2↑ D.电解MgCl2水溶液的离子方程式:2Cl?+2H2O |
|
| 9. | 详细信息 |
|
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3?2HNO3+4N2+9H2O,在反应中还原产物与氧化产物的质量之比为( ) A.5:3 B.5:4 C.1:1 D.3:5 |
|
| 10. | 详细信息 |
|
已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( ) A.KMnO4 B.Ca(ClO)2 C.Cl2 D.H2O2 |
|
| 11. | 详细信息 | ||||||||||
某溶液中,若忽略水的电离,只含有下表中所示的四种离子,试推测X离子及其个数b可能为( )
|
|||||||||||
| 12. | 详细信息 |
|
把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42?完全沉淀,则原溶液中NO3?的物质的量浓度为( ) A. B. C. D. |
|
| 13. | 详细信息 |
|
把一小块金属钠放入下列溶液中,既能产生气体又会生成白色沉淀的是( ) A.稀硫酸 B.氢氧化钾稀溶液 C.硫酸铜溶液 D.氯化镁溶液 |
|
| 14. | 详细信息 |
|
只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( ) A.NaOH B.H2SO4 C.BaCl2 D.AgNO3 |
|
| 15. | 详细信息 |
|
在给定的条件下,下列选项所示的物质间转化均能实现的是( ) A.SiO2 B.FeS2 C.N2 D.MgCO3 |
|
| 16. | 详细信息 |
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( ) A.a点对应的溶液中:Na+、Fe3+、SO42?、HCO3? B.b点对应的溶液中:Na+、S2?、SO42?、Cl? C.c点对应的溶液中:Ag+、Ca2+、NO3?、F? D.d点对应的溶液中:K+、NH4+、I?、CO32? |
|
| 17. | 详细信息 |
|
下列叙述正确的是( ) A.SO2具有还原性,故可作漂白剂 B.Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg C.浓硝酸中的HNO3见光易分解,故有时在实验室看到的浓硝酸呈黄色 D.Fe在Cl2中燃烧生成FeCl3 , 故在与其他非金属反应的产物中的Fe也显+3价 |
|
| 18. | 详细信息 |
已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如图,则甲和X不可能是( ) A.甲为C,X是O2 B.甲为SO2 , X是NaOH溶液 C.甲为Cl2 , X为Fe D.甲为Al,X为NaOH溶液 |
|
| 19. | 详细信息 | |||||||||||||||
下述实验能达到预期目的是( )
|
||||||||||||||||
| 20. | 详细信息 |
|
下列解释物质用途或现象的反应方程式不准确的是( ) A.硫酸型酸雨的形成会涉及反应:2H2SO3+O2 B.工业上制取粗硅的化学方程式:SiO2+C C.Na2 S2O3溶液中加入稀硫酸:S2O+2H D.成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl?+ClO?+2H+?Cl2↑+H20 |
|
| 21. | 详细信息 |
|
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( ) A.加入KSCN溶液一定不变红色 B.溶液中一定含Cu2+ C.溶液中一定含Fe2+ D.剩余固体中一定含铜 |
|
| 22. | 详细信息 |
|
使用单质铜制硝酸铜,耗用原料最经济,而且对环境几乎没有污染的是( ) A.Cu B.Cu C.Cu D.Cu |
|
| 23. | 详细信息 |
|
下列物质中不能用化合反应的方法制得的是( ) ①SiO2 ②H2SiO3 ③Fe(OH)3 ④Al(OH)3⑤FeCl2 ⑥CaSiO3 . A.①③ B.②④ C.②③④⑤ D.②④⑥ |
|
| 24. | 详细信息 |
|
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是 ( )  A.X元素可能为Al B.X元素一定为非金属元素 C.反应①和②互为可逆反应 D.反应①和②不可能都为氧化还原反应 |
|
| 25. | 详细信息 |
|
下列各项反应对应的图象正确的是( ) A.  25℃时,向亚硫酸溶液中通入氯气 B. 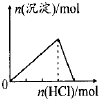 向NaAlO2溶液中通入HCl气体 C. 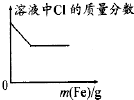 向少量氯化铁溶液中加入铁粉 D.  向BaSO4饱和溶液中加入硫酸钠 |
|
| 26. | 详细信息 |
|
标准状况下有①6.72L CH4;②3.01×1023个HCl分子;③7.2gH2O,下列对这三种物质的关系从小到大的排列顺序是: (1)物质的量 ; (2)体积 ; (3)质量 ; (4)氢原子数 . |
|
| 27. | 详细信息 |
|
按要求写出相应的式子: (1)过氧化钠与水反应的化学方程式: ; (2)实验室制取氯气的离子方程式: ; (3)铜与稀硝酸反应的离子方程式: . |
|
| 28. | 详细信息 |
|
现有下列状态的物质①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融的KOH ⑧蔗糖, 其中属于电解质的是 , 属于强电解质的是 . 能导电的是 . |
|
| 29. | 详细信息 |
|
胶体是一种常见的分散系,回答下列问题. ①向煮沸的蒸馏水中逐滴加入 溶液,继续煮沸至 , 停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为 . ②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于 离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做 . ③区分胶体和溶液常用的方法叫做 . |
|
| 30. | 详细信息 |
|
①FeCl3溶液用作蚀刻铜箔制造电路板的工艺,离子方程式为 . ②有学生利用FeCl3溶液制取FeCl3?6H2O晶体主要操作包括:滴入过量盐酸, 、冷却结晶、过滤.过滤操作除了漏斗、烧杯还需要什么玻璃仪器 . ③高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3与KClO在强碱性条件下反应可制取K2FeO4 , 反应的离子方程式为 . |
|
最近更新



