2015-2016年高一下册化学开学考试(河南省新乡市延津一中)
| 1. | 详细信息 |
|
下列说法中正确的是( ) A.氯化钾溶液在电流作用下电离成K+和Cl- B.氧化还原反应的本质是有化合价的升降 C.依据丁达尔效应可将分散系分为溶液、胶体与浊液 D.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第二位 |
|
| 2. | 详细信息 |
|
若NA表示阿伏加德罗常数的值,下列说法正确的是 ( ) A.1 mol Cl2作为氧化剂得到的电子数为NA B.在0℃、101 kPa时,22.4 L氢气中含有NA个氢原子 C.14 g氮气中含有7NA个电子 D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4 |
|
| 3. | 详细信息 |
|
在下列各组溶液中,离子间一定能大量共存的是( ) A.pH=1的溶液:K+、Cu2+、Br?、SO42? B.含有0.1 molL?1I?的溶液:NH4+、Fe3+、SO42?、Cl? C.含有0.1 molL?1HCO3?的溶液:Na+、Al3+、NO3?、OH? D.强酸性溶液:K+、Mg2+、NO3?、ClO? |
|
| 4. | 详细信息 |
|
下列装置或操作能达到相应实验目的的是( ) A.  排水集气法收集NO 排水集气法收集NOB.  实验室制取氨气 实验室制取氨气C. 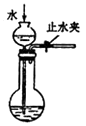 检查装置气密性 检查装置气密性D.  配制稀硫酸 配制稀硫酸 |
|
| 5. | 详细信息 |
|
下列现象或事实不能用同一原理解释的是( ) A.浓硝酸和氯水用棕色试剂瓶保存 B.硫化钠和亚硫酸钠固体长期暴露在空气中变质 C.常温下铁和铂都不溶于浓硝酸 D.SO2和Na2SO3溶液都能使氯水褪色 |
|
| 6. | 详细信息 |
|
下列叙述不正确的是( ) A.用SiO2制备硅酸不可能一步完成 B.使用澄清的石灰水可以鉴别Na2CO3和NaHCO3两种白色固体 C.把铁粉和铜粉放入FeCl3溶液充分反应后有固体剩余,固体中可能有铜无铁 D.烧碱溶液应保存在塞有橡胶塞的细口玻璃瓶中 |
|
| 7. | 详细信息 |
|
下列说法中不正确的是( ) A.工业上炼铁的原料是赤铁矿 B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入过量铁粉,然后过滤 D.进行焰色反应,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 |
|
| 8. | 详细信息 |
下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物.B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液显红色.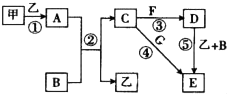 请回答下列问题: (1)A是 . (2)反应①~⑤中,属于氧化还原反应的是 填序号). (3)反应⑤的化学方程式为 ;甲与B反应的离子方程式为 . (4)在空气中将C溶液滴入F溶液中,观察到的现象是 . |
|
| 9. | 详细信息 |
|
A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他物质已经略去): A (1)若A是黄色晶体;B为酸雨的成因之一,且可使品红溶液褪色,则将B通入KMnO4溶液的现象为: ;体现B的 (填“氧化性”“还原性”“漂白性”); 请写出D的浓溶液与单质铜反应的化学方程式: ;此反应中作氧化剂的D与参加反应的D的物质的量之比为: ; (2)若A气体可使湿润的红色石蕊试纸变蓝,常温下D的浓溶液能使金属Fe、Al钝化,请写出实验室制备A的化学方程式: 请写出C→D的离子方程式: . |
|
| 10. | 详细信息 |
|
有一瓶无色透明溶液,其中可能含有Na+、Mg2+、Ba2+、Al3+、Fe3+、SO42?、CO32?、I? . 取该溶液进行以下实验: ①用PH试纸测得该溶液显酸性; ②取部分溶液,加入数滴新制氯水及少量CCl4 , 经振荡、静置后,CCl4层呈紫红色; ③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐变至碱性,在整个滴加过程中无沉淀生成; ④取部分③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成; (1)该溶液为无色透明溶液,可确定其中一定不含 ;(填离子符号,下同) (2)由步骤①可知,溶液中一定不存在 ; (3)由步骤②可知,溶液中含有 ; (4)由步骤③可排除 、 的存在; (5)由步骤④可知,溶液中含有 , 由此可排除 的存在; (6)试验中不能够确定是否存在的阳离子可用 (填操作名称)进行检验. |
|
高中化学 试卷推荐
- 2019-2020年高二上学期第二次月考化学免费试卷完整版(安徽省潜山第二中学)
- 2018至2019年高二下册期末考试化学题带答案和解析(黑龙江省大庆市三校联考)
- 海安高级中学2019年高三化学上半年月考测验带答案与解析
- 高二下册期末学业质量检测化学题免费试卷(2019-2020年广东省珠海市)
- 2019-2020年高三上半期期中考试化学试卷完整版(上海市复旦大学附属中学)
- 2019-2020年高一上学期期中考试化学题带答案和解析(江西省南康中学)
- 2018至2019年高一下期第二次月考化学免费试卷完整版(河北省黄骅中学)
- 陕西省商洛市洛南中学2020-2021年高二前半期第一次月考化学题免费试卷
最近更新



