白银市2019年高三化学上学期月考测验免费检测试卷
| 1. | 详细信息 |
如图是某学校购买的硫酸试剂标签上的部分内容.据此下列说法正确的是( ) A. 该硫酸的物质的量浓度为1.84mol/L B. 1mol Zn与足量的该硫酸反应产生2gH2 C. 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL D. 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L |
|
| 2. | 详细信息 |
|
某温度下,物质X2SO4的饱和溶液密度为ρg·mL-1,c(X+)=cmol·L-1 ,溶质 的质量分数为a% ,溶质的摩尔质量为Mg·mol-1,溶解度为Sg,下列表达式正确的是( ) A. c=2000ρa/M B. a%=c/2000ρ C. M=1000ρa%/c D. S=100cM/(2000ρ-cM) |
|
| 3. | 详细信息 | ||||||||||||||||||||
下列实验操作、理象和结论均正确的是( )
|
|||||||||||||||||||||
| 4. | 详细信息 |
|
下列各组中的反应,属于同一反应类型的是( ) A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 C. 由氯代环已烷制环已烯;由丙烯制1,2二溴丙烷 D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 |
|
| 5. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是( ) A. 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA B. 标准状况下,由H2O2制得4.48LO2转移的电子数目为0.8NA C. 14g由乙烯与环丙烷组成的混合气体含有的碳原子数目为NA D. 25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0.1NA |
|
| 6. | 详细信息 |
|
下面实验操作不能实现实验目的的是( ) A. 鸡蛋白溶液中,加入浓的硫酸铵溶液有沉淀析出,加入水后沉淀溶解 B. 用银氨溶液可以鉴别葡萄糖和乙酸溶液。 C. 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 D. 取少量淀粉溶液,加入一定量稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并加热,观察现象,判断淀粉水解的产物中是否含有葡萄糖 |
|
| 7. | 详细信息 |
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是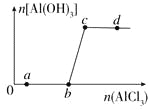 A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3- B. b点对应的溶液中:Ag+、Ca2+、NO3-、F- C. c点对应的溶液中:Na+、S2-、SO42-、Cl- D. d点对应的溶液中:K+、NH4+、I-、CO32- |
|
| 8. | 详细信息 |
|
三氟化氮(NF3)(氟只有两种价态:-1,0)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O A. NF3是氧化剂,H2O是还原剂 B. 若1mol NF3被氧化,反应转移电子数为2NA C. 若生成0.4molHNO3,则转移0.4mol电子 D. 氧化剂与还原剂的物质的量之比为1∶2 |
|
| 9. | 详细信息 | |||||||||||||||
下列离子方程式的书写及评价,均合理的是
|
||||||||||||||||
| 10. | 详细信息 |
|
下列各组物质相互混合反应后,最终有白色沉淀生成的是( ) ①金属钠投入到FeCl2溶液中 ②过量NaOH溶液和明矾溶液混合 ③少量Ca(OH)2投入过量NaHCO3溶液中 ④向饱和Na2CO3溶液中通入过量CO2. A. ①②③④ B. ①④ C. ③④ D. ②③ |
|
| 11. | 详细信息 |
胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法:  ①该化合物属于芳香烃; ②分子中至少有7个碳原子处于同一平面; ③它的部分同分异构体能发生银镜反应; ④1 mol该化合物最多可与2 mol Br2发生反应。 其中正确的是( ) A. ②③ B. ①②④ C. ①③ D. ②③④ |
|
| 12. | 详细信息 |
|
向含H2S、Fe2+、Br-、I-各0.1 mol的溶液中通入Cl2 ,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是( ) A.  B. B. 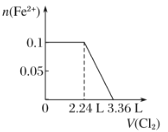 C. C. 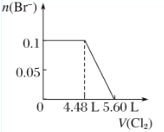 D. D.  |
|
| 13. | 详细信息 |
|
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是( ) A. c=1000b/11.2V B. p=m+Vc/125 C. n=m+17Vc D. 5m/3<p<17m/9 |
|
| 14. | 详细信息 | ||||||||||||||||||||||||||
在 Na+浓度为 0.5mol/L 的某澄清溶液中,还可能含有下表中的若干种离子:
|
|||||||||||||||||||||||||||
| 15. | 详细信息 |
化学兴趣小组同学想用金属钠和空气制备纯度较高的Na2O2(N2不与金属钠应),可利用的装置如下。回答下列问题: (1)装置Ⅳ中盛放的药品是________,若没有该装置可能导致生成的Na2O2中含有碳酸钠,其反应方程式为____________________________。 (2)若规定气体的气流方向从左到右,各仪器接口的标号字母(a、b……)顺序: 空气进入h,________接________,________接________,________接________,d (3)装置Ⅱ的作用是_____________________________________________________。 (4)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。 ①使酚酞溶液变红是因为________________,红色褪去的可能原因是____________________。 ② 加入MnO2反应的化学方程式为__________________________。 |
|
| 16. | 详细信息 |
|
根据信息写方程式: (1)Pb与C同主族,化合价有+2价和+4价,PbO与PbO2是铅的两种常见氧化物,已知PbO2具有强氧化性,与浓盐酸共热可生成一种黄绿色气体和PbCl2 。试写出Pb3O4与浓盐酸反应的化学方程式:__________________________________。 (2)过氧化钠可用于实验室制O2,其化学方程式为__________________________________。 (3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为______________________________。 (4)Fe的一种含氧酸根FeO42-- 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是__________________________________。 (5)向菱镁矿(主要成分为MgCO3,含少量FeCO3)中,首先加入稀硫酸,过滤后,再加入H2O2。写出加入H2O2氧化时发生反应的化学方程式:______________________________________。 |
|
| 17. | 详细信息 |
化合物H 是一种仿生高聚物( )的单体。由化合物A(C4H8)制备H的一种合成路 线如下 : )的单体。由化合物A(C4H8)制备H的一种合成路 线如下 :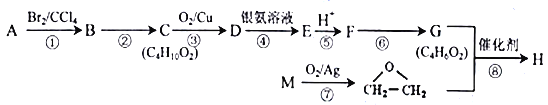 已知: A 与M 互为同系物。回答下列问题: (1)A的系统命名为_____________。D分子中含有的官能团名称为__________________。 (2)F→G的反应条件为______________________。反应②、⑦的反应类型分别为_________、_________。 (3)反应⑧的化学方程式为___________________________________。 (4)化合物X 为H 的同分异构体,X 能与新制的氢氧化铜悬浊液反应生成砖红色沉淀,还能与Na2CO3饱和溶液反应放出气体,其核磁共振氢谱有4 种峰。写出两种符合要求的X 的结构简式_____________________________________________________。 (5)根据上述合成中的信息,试推写出以乙烯、乙酸为原料经三步制备CH3-COOCH=CH2的合成路线_______________________________________(其他试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。 |
|



