邯郸市高三化学2019年前半期月考测验在线答题
| 1. | 详细信息 |
|
中国古代四大发明是:造纸术、指南针、火药、活字印刷术。来自“一带一路”沿线的20国青年评选出了中国的“新四大发明”:网购、支付宝、中国高铁、共享单车。“新四大发明”中与化学关系最密切的一项是 A. 网购 B. 支付宝 C. 中国高铁 D. 共享单车 |
|
| 2. | 详细信息 |
国产自主研发芯片麒麟970是全球首款内置神经网络单元的处理器,该处理器芯片中使用的材料是 A. 硅 B. 钛合金 C. 二氧化硅 D. 铅合金 |
|
| 3. | 详细信息 |
|
纯碱在玻璃、肥皂、造纸、食品等工业中有广泛的应用,纯碱属于 A. 酸 B. 碱 C. 盐 D. 氧化物 |
|
| 4. | 详细信息 |
在沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色。下列说法正确的是 A. 用激光笔照射,会出现丁达尔效应 B. 将液体静置片刻,会出现沉淀现象 C. 所得胶体中分散质的粒子直径大于100nm D. 可用滤纸分离提纯得到氢氧化铁胶体 |
|
| 5. | 详细信息 |
|
下列解释事实的方程式不正确的是 A. 焊接铁轨:2Fe+Al2O3 B. 人工固氮:N2+3H2 C. 用纯碱除油污:CO32-+H2O D. 用湿润的淀粉KI试纸检验Cl2:Cl2+2I-=2Cl-+I2 |
|
| 6. | 详细信息 |
|
下列反应的现象描述与离子方程式都正确的是( ) A. 金属镁与稀盐酸反应:有气泡逸出 Mg+2H++2Cl-===MgCl2+H2↑ B. 氯化钡溶液与稀硫酸反应:有白色沉淀生成 Ba2++SO42-===BaSO4↓ C. 碳酸镁与盐酸反应:有气泡逸出 CO32-+2H+===CO2↑+H2O D. NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生 2HCO3-+Ba2++2OH-===BaCO3↓+2H2O+CO32- |
|
| 7. | 详细信息 |
|
金属加工后的废切削液中含2%~3%的NaNO2,它是一种环境污染物,人们用NH4Cl溶液来处理废切削液,使NaNO2转化为无毒物质,该反应分两步进行: 第一步:NaNO2+NH4Cl=NaCl+NH4NO2 第二步:NH4NO2=N2↑+2H2O 下列对第二步反应的叙述中正确的是 ①NH4NO2只是氧化剂 ②NH4NO2只是还原剂 ③NH4NO2发生了分解反应 ④只有氮元素的化合价发生了变化 ⑤NH4NO2既是氧化剂又是还原剂 A. ①③ B. ①④ C. ②③④ D. ③④⑤ |
|
| 8. | 详细信息 |
用下列实验装置进行相应实验,能达到实验目的的是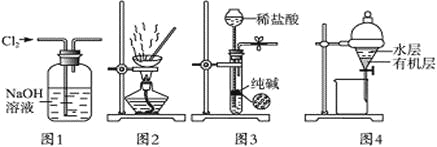 A. 用图1所示装置除去Cl2中含有的少量HCl B. 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 C. 用图3所示装置制取少量纯净的CO2气体 D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
|
| 9. | 详细信息 | |||||||||||||||
下列实验操作或事实与预期实验目的或所得结论对应正确的是( )
|
||||||||||||||||
| 10. | 详细信息 |
|
将一定量CO2通入NaOH溶液中,将充分反应后的溶液减压蒸发得到固体。下列对所得固体的成分说法中不正确的是 A.所得固体可能由NaOH和Na2CO3组成 B.所得固体可能由NaOH和NaHCO3组成 C.所得固体可能由Na2CO3和NaHCO3组成 D.所得固体可能只含有NaHCO3 |
|
| 11. | 详细信息 |
|
向铝粉中添加少量NH4Cl固体并充分混合,其中铝粉在1000℃时可与N2反应制备AlN,下列说法正确的是 A. AlN是一种金属材料 B. AlN与足量氢氧化钠溶液共热时生成氢氧化铝和氨气 C. 少量NH4Cl能够破坏Al表面的Al2O3薄膜 D. AlN与足量盐酸反应的离子方程式为AlN+3H+=Al3++NH3↑ |
|
| 12. | 详细信息 |
|
为了检验某氯化亚铁溶液是否变质,最好向溶液中加入 A. NaOH 溶液 B. 铁片 C. KSCN 溶液 D. 石蕊试液 |
|
| 13. | 详细信息 |
|
用毛笔蘸取少量30%FeCl3溶液在铜片上写一个“Cu”字,放置片刻,用少量水将铜片上的溶液冲到小烧杯中,下列说法正确的是( ) A. 烧杯中的溶液呈黄色 B. 铜片无任何变化 C. 铜片上有凹陷的“Cu”字 D. 发生了反应:Fe3++Cu===Cu2++Fe2+ |
|
| 14. | 详细信息 |
|
把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3︰1,则原混合物中Fe2O3与Fe的物质的量之比为( ) A. 1︰1 B. 2︰5 C. 4︰1 D. 3︰1 |
|
| 15. | 详细信息 |
|
铁、铜混合粉末18.0 g加入到100 mL 5.0 mol·L-1 FeCl3 溶液中,剩余固体质量为3.2 g。下列说法正确的是( ) A. 剩余固体是铁、铜混合物 B. 原固体混合物中铜的质量是9.6 g C. 反应后溶液中n(Fe3+)=0.10 mol D. 反应后溶液中n(Fe2+)+n(Cu2+)=0.5 mol |
|
| 16. | 详细信息 |
由二氧化硅制高纯硅的流程如下,下列判断中错误的是 A. ①②③均属于氧化还原反应 B. H2和HCl均可循环利用 C. SiO2是一种坚硬难熔的固体 D. SiHCl3摩尔质量为135.5g |
|
| 17. | 详细信息 |
|
将一定量的某镁铝合金放入足量稀盐酸中,生成H2的体积在标准状况下为2240 mL,将相同量的该镁铝合金放入足量的NaOH溶液中,生成H2的体积在标准状况下为2016mL,则该合金中Mg、Al的质量之比是( ) A. 1:1 B. 6:1 C. 1:6 D. 4:27 |
|
| 18. | 详细信息 |
某离子反应涉及H2O、Cr2O72-、NO2-、H+、NO3-、Cr3+六种微粒,已知反应过程中NO3-浓度变化如图所示,且氧化剂和还原剂的物质的量之比为1∶3,下列判断错误的是( ) A. Cr2O72-中Cr化合价是+6 价 B. 反应的氧化产物是NO3- C. 消耗1mol氧化剂,转移电子6mol D. 反应中Cr3+被氧化 |
|
| 19. | 详细信息 |
高铁酸钾(K2FeO4) 是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: (1)反应①应在温度较低的情况下进行(因在温度较高时KOH 与Cl2 反应生成的是KClO3。)写出①的化学方程式_____________________。 (2)在溶液I中加入KOH 固体的目的是_____________________。(填编号) A.与反应液I中过量的Cl2继续反应,生成更多的KClO B.KOH 固体溶解时会放出较多的热量,有利于反应进行 C.为下一步反应提供碱性的环境 D.使KClO3 转化为KClO (3)从溶液Ⅱ中分离出K2FeO4 后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为__________________________________________。 (4)如何判断K2FeO4 晶体已经洗涤干净___________________。 |
|
| 20. | 详细信息 |
|
阅读相关信息,结合所学知识,回答下列问题: 铝和锌都是两性金属元素。其氢氧化物都是白色沉淀,既能溶于强酸,又能溶于强碱(生成AlO2-或ZnO22-)。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。 (1)写出锌和氢氧化钠溶液反应的化学方程式_______________________________。 (2)用氨水除去Al(OH)3中的Zn(OH)2的离子方程式为________________________。 (3)写出向AlCl3溶液中滴入过量氨水的离子方程式___________________;向ZnCl2溶液中逐滴滴入氨水直至过量的现象是_______________________________________。 (4)下列各组中的两种溶液,只用胶头滴管和试管即可鉴别的是______________。 A.硫酸铝和氢氧化钠 B.硫酸铝和氨水 C.硫酸锌和氢氧化钠 D.硫酸锌和氨水 |
|
| 21. | 详细信息 |
|
某小组同学在制备氢氧化铜时,将20mL 2mol/L的NaOH溶液滴入50mL 1mol/L的CuSO4溶液中,得到了绿色沉淀.这与“氢氧化铜是蓝色沉淀”这一文献说法不符,为探究该绿色沉淀的成分,他们做了如下实验进行探究.. [实验一] 将20mL 1mol/L的CuSO4溶液滴入50mL 2mol/L的NaOH溶液中,观察到生成了蓝色沉淀. [实验二] ①将绿色沉淀过滤、洗涤、低温烘干. ②称取2.58g该绿色沉淀,投入50mL 2mol/L的NaOH溶液中,剧烈振荡,沉淀变成蓝色,过滤、洗涤,并将洗涤液转移到滤液中,低温烘干称量得蓝色沉淀为1.96g. ③向②的滤液中加入足量氯化钡溶液,有白色沉淀生成,过滤、洗涤、烘干后称量为2.33g. 请回答下列问题: (1)配制220ml 1mol/L的硫酸铜溶液除需用托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管外,还需要的玻璃仪器是____,在实验中需称量胆矾___克 (2)该组同学做实验一的目的或作用是___________ (3)实验二中第①步洗涤沉淀的方法是_____________________ (4)通过计算,该绿色沉淀的成分可表示为________________. |
|
| 22. | 详细信息 |
工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量.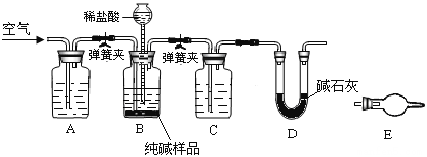 (1)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若________________,说明装置不漏气. (2)装置A的作用是____,装置C中的试剂为___. (3)某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要?____(选填“必要”或“不必要”),判断的理由是____________________. (4)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为_____. |
|
最近更新



