2016-2017年高二下册开学考试化学在线测验(安徽省六安市第一中学)
| 1. | 详细信息 |
|
下列各项叙述中,正确的是( ) A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 B.24Cr原子的电子排布式是1s22s22p63s23p63d44s2 C.若某基态原子的外围电子排布为4d25s2 , 它是第五周期IVB族元素 D.M层全充满而N层为4s1的原子和位于第四周期第ⅠA族的原子是同一种元素 |
|
| 2. | 详细信息 |
|
五种短周期主族元素A、B、C、D、E的原子序数依次递增,A2属于绿色燃料,C的氧化物常用于玻璃的生产,D元素原子的核电荷数是同主族上一周期元素的2倍,B、C为同周期元素,B、D原子最外层电子数之和等于E的最外层电子数.根据以上叙述,下列说法中正确的是( ) A.元素C,D,E的最高价氧化物对应水化物的酸性递减 B.元素D,E分别与元素A形成化合物的稳定性:A2D>AE C.D,E简单离子的还原性顺序为:D>E D.元素B,D,E的简单离子半径大小为:B>D>E |
|
| 3. | 详细信息 |
|
下列有关热化学方程式的叙述中,正确的是( ) A.含20.0gNaOH的稀溶液与足量稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.8kJ/mol B.已知热化学方程式:SO2(g)+ C.已知2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol D.已知H+(aq)+OH-(aq)=H2O(1) △H=-57.31kJ?mol-1 , 故Ba2+(aq)+H+(aq)+OH-(aq)+SO42-(aq)=H2O(1)+BaSO4(s) △H<-57.31kJ?mol-1 |
|
| 4. | 详细信息 |
在体积为VL的恒容密闭容器中盛有一定量H2 , 通入Br2(g)发生反应:H2(g)+Br2(g)  A.由图可知:T2>T1 B.a、b两点的反应速率:b>a C.为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法 D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加 |
|
| 5. | 详细信息 | ||||||||||||||||||||
将等物质的量的X、Y气体充入一个容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)
|
|||||||||||||||||||||
| 6. | 详细信息 |
|
25℃时,在等体积的 ① pH=0的H2SO4溶液 ②0.05mol?L-1的Ba(OH)2溶液 ③pH=10的Na2S溶液 ④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( ) A.1∶10∶1010∶109 B.1∶5∶5×109∶5×108 C.1∶20∶1010∶109 D.1∶10∶104∶109 |
|
| 7. | 详细信息 |
|
实验室用标准KMnO4溶液滴定未知浓度的FeSO4溶液,下列说法或操作正确的是( ) A.盛 FeSO4溶液的锥形瓶滴定前用FeSO4溶液润洗2-3次 B.选碱式滴定管盛放标准KMnO4溶液,并用碘化钾淀粉溶液作指示剂 C.锥形瓶内溶液颜色变化由黄色变浅紫色,立即记下滴定管液面所在刻度 D.滴定前仰视读数,滴定后俯视读数会导致滴定结果偏低 |
|
| 8. | 详细信息 |
|
下列说法不正确的是( ) A.将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 B.相同pH的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A) D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH)>c(SO42-)>c(OH-)=c(H+) |
|
| 9. | 详细信息 | ||||||||
部分弱酸的电力平衡常数如下表所示:
下列选项正确的是( )。 |
|||||||||
| 10. | 详细信息 |
在不同温度下,水溶液中c(H+)与c(OH-)关系如图所示。下列说法不正确的是( )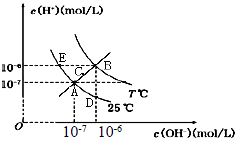 A.图中五点Kw间的关系:B>C>A=D=E B.E 点对应的水溶液中,可能有NH4+、Ba 2+、Cl-、I-大量同时存在 C.若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则溶液中有:c(HA-)>c(OH-)>c(A2- )>c(H2A) D.向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A 点所示,则溶液中反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
|
| 11. | 详细信息 |
室温下,用相同浓度的NaOH 溶液,分别滴定浓度均为0.1mol?L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )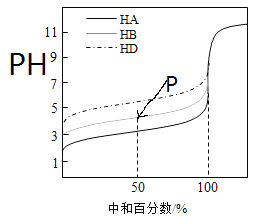 A.三种酸的电离常数关系:KHA>KHB>KHD B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+) |
|
| 12. | 详细信息 | ||||||||||||||||||||
下列根据实验操作和现象得出结论不正确的是( )
|
|||||||||||||||||||||
| 13. | 详细信息 |
|
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法不正确的是( ) A.在熔融电解质中,O2-移向负极 B.电池的总反应是:2C4H10+13O2=8CO2+10H2O C.通入丁烷的一极是负极,电极反应为:C4H10-26e-+13O2-=4CO2↑+5H2O D.通入空气的一极是正极,电极反应为:O2+4e-+4H+ =2H2O |
|
| 14. | 详细信息 |
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )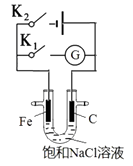 A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑ B.K1闭合,石墨棒周围溶液pH逐渐升高 C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体 |
|
| 15. | 详细信息 |
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法不正确的是( )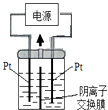 A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH- B.电解结束后,右侧溶液中含有IO3- C.电解槽内发生反应的总化学方程式:KI+3H2O=KIO3+3H2↑ D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变。 |
|
| 16. | 详细信息 | ||||||||||
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)
|
|||||||||||
| 17. | 详细信息 | ||||||||||||
A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
请回答下列问题(用对应元素的元素符号作答): |
|||||||||||||
| 18. | 详细信息 | ||||||||||||||||||||||||||||||||||||
|
煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。 (1)已知:①C(s)+H2O(g)?CO(g)+H2(g) △H=+131.3kJ?mol-1 ②CO2(g)+H2(g)?CO(g)+H2O(g) △H=+41.3kJ?mol-1 则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为 。该反应在 (填“高温”、“低温”或“任何温度”)下有利于正向自发进行。 (2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g)
①10~20min内,N2的平均反应速率v(N2)= 。
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol?L-1 , 在该条件下达到平衡时,CO的转化率为 。 |
|||||||||||||||||||||||||||||||||||||
| 19. | 详细信息 |
Ⅰ.如图是一个电化学过程的示意图。 请回答下列问题: (1)写出通入CH3OH的电极的电极反应式 。 (2)乙池中反应的化学方程式为 , 当乙池中B极质量增加5.4g,甲池中理论上消耗O2的体积为 L(标准状况下),此时丙池中析出1.6g某金属,则丙池中的某盐溶液可能是 (填序号) A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液 Ⅱ.NO2 可通过点解制备绿色硝化试剂N2O5。下图是其原理示意图。 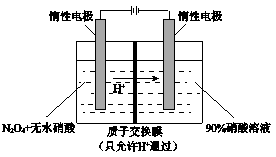 阳极区生成N2O5的电极反应式是 。 |
|
| 20. | 详细信息 |
醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下: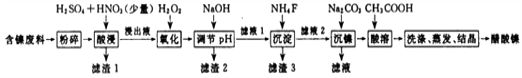 相关离子生成氢氧化物的pH和相关物质的溶解性如下表: 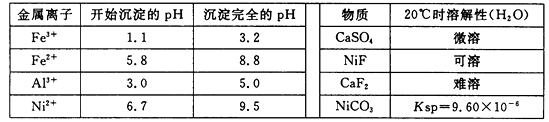 (1)调节pH步骤中,溶液pH的调节范围是 。 (2)滤渣1和滤渣3主要成分的化学式分别是 、 。 (3)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式 。 (4)沉镍前c(Ni2+)=2.0 mol? L-1 , 欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol?L-1],则需要加入Na2CO3固体的质量最少为 g。(保留小数点后1位) |
|
| 21. | 详细信息 |
|
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。 (1)Ⅰ.将NaOH溶液与NH4Cl溶液混合生成NH3?H2O ,从而验证NaOH的碱性大于NH3?H2O继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: 。 (2)Ⅱ.利用下图装置可以验证非金属性的变化规律。干燥管D的作用是 。  实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2 , 请选择合适药品设计实验验证氯的非金属性大于硫:烧瓶中发生反应的离子方程式为 。 装置C中的实验现象为有淡黄色沉淀生成,离子方程式为 。 (3)若要用此装置证明酸性:H2CO3>H2SiO3进而证明非金属性:C>Si,则A中加 观察到C中溶液的现象为 。 |
|



