2017-2018年高一1月月考化学试卷(四川省眉山中学)
| 1. | 详细信息 |
|
下列物质可以在乘车、船或飞机时较大量随身携带的是( ) A. 浓硫酸 B. 高锰酸钾 C. 硫黄 D. 硫酸钾 |
|
| 2. | 详细信息 |
|
下列物质中不属于电解质的是 ( ) A. 氢氧化钠 B. 硫酸铁 C. 氯化钠 D. 蔗糖 |
|
| 3. | 详细信息 |
|
下列各组物质,按化合物、单质、混合物顺序排列的是( ) A. 烧碱、液态氧、干冰 B. 生石灰、白磷、漂白粉 C. 氯水、铁红、氯化氢 D. 空气、氮气、胆矾 |
|
| 4. | 详细信息 |
|
有关物质与反应分类的下列说法中,正确的是? ( ) A. 碳酸钠使无色酚酞试液变红,属于碱 B. CO2溶于水能导电,属电解质 C. 硅酸钠是钠盐,也是硅酸盐 D. CO还原氧化铁获得铁,属于置换反应 |
|
| 5. | 详细信息 |
|
下列过程属于化学变化的是( ) ①活性炭吸附有色物质 ②氯水漂白有色布条? ③过氧化钠露置在空气中 ④将氯气通入水中,溶液呈浅黄绿色? ⑤过量过氧化钠加入含酚酞的溶液,溶液先变红后褪色? ⑥利用焰色反应鉴别NaCl和KCl A. ①②③⑤ B. ①②④⑥ C. ②③④⑤ D. ③④⑤⑥ |
|
| 6. | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列叙述正确的是( ) A. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-的数目为 NA B. 11.2 g Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA C. 标准状况下,22.4LH2O含有的分子数为NA D. 2.3 g Na与一定量氧气反应生成Na2O和Na2O2的混合物,转移的电子数一定为0.1NA |
|
| 7. | 详细信息 |
|
如下试剂的保存方法,其中不能用氧化还原反应解释的是( ) A. 钠保存在煤油中 B. 氯水保存在棕色的试剂瓶中 C. 保存FeSO4溶液需加入少量铁粉 D. 盛装NaOH溶液的试剂瓶不能用玻璃塞 |
|
| 8. | 详细信息 |
|
下列离子方程式书写正确的是( ) A. 氧化亚铁与稀盐酸反应:FeO + 2H+ B. 过氧化钠与水的反应:Na2O2 + 2H2O C. 氯化铝溶液中加入过量氨水:Al3+ + 3OH- D. 氢氧化铝与氢氧化钠溶液反应: Al(OH) 3 + OH- = AlO2- +? 2H2O |
|
| 9. | 详细信息 |
|
下列图示实验操作,能达到目的的是( ) A. 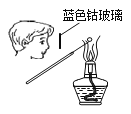 检验K+的存在 B. 检验K+的存在 B. 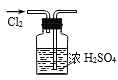 干燥氯气 干燥氯气C. 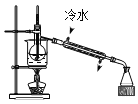 分离酒精与水 D. 分离酒精与水 D. 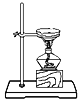 蒸发食盐水 蒸发食盐水 |
|
| 10. | 详细信息 |
|
在强酸性无色透明溶液中,下列各组离子能大量共存的是( ) A. Fe3+、K+、Cl-、MnO4- B. Ag+、Na+、NO3-、AlO2- C. Zn2+、Al3+、SO42-、Cl- D. Ba2+、NH4+、Cl-、HCO3- |
|
| 11. | 详细信息 |
|
下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是( ) A. 稀盐酸,Na2CO3溶液 B. 稀H2SO4溶液,NaAlO2溶液 C. Cl2,NaBr溶液 D. CO2,澄清石灰水 |
|
| 12. | 详细信息 |
|
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为 A. 3:1 B. 2:1 C. 1:1 D. 1:3 |
|
| 13. | 详细信息 |
|
把少量废铁屑溶于过量稀硫酸中,过滤,除去杂质,在滤液中加入过量氯水,再加入过量的氨水,有沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到固体残渣。上述沉淀和残渣分别为 A. Fe(OH)2 ;Fe2O3 B. Fe(OH)2;FeO C. Fe(OH)2、Fe(OH)3;Fe2O3 D. Fe(OH)3;Fe2O3 |
|
| 14. | 详细信息 |
|
下列有关物质用途的说法中,不正确的是( ) A. 二氧化硅是目前人类将太阳能转换为电能的常用材料 B. 氧化铝是冶炼金属铝的原料,也是一种比较好的耐火材料 C. 过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 D. 三氧化二铁常用作红色油漆和涂料 |
|
| 15. | 详细信息 |
|
将一定量CO2通入NaOH溶液中,将充分反应后的溶液减压蒸发得到固体。下列对所得固体的成分说法中不正确的是 A.所得固体可能由NaOH和Na2CO3组成 B.所得固体可能由NaOH和NaHCO3组成 C.所得固体可能由Na2CO3和NaHCO3组成 D.所得固体可能只含有NaHCO3 |
|
| 16. | 详细信息 | ||||||||||||||||||||
下列除去杂质的方法中错误的是( )
|
|||||||||||||||||||||
| 17. | 详细信息 |
|
用稀H2SO4、NaOH和Al为原料制取Al(OH)3, 有下列三种不同的途径: 甲: 乙: 丙: 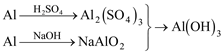 若制取等量的Al(OH)3则( ) A. 甲、乙消耗的原料同样多 B. 乙消耗的原料最少 C. 丙消耗的原料最少 D. 三者消耗的原料同样多 |
|
| 18. | 详细信息 |
|
某无色溶液可能由Na2CO3、MgCl2、NaHCO3、BaCl2中的一种或几种混合而成。该溶液加入NaOH溶液出现白色沉淀;加入稀H2SO4也出现白色沉淀,并放出气体。据此分析,下述组合判断正确的( ) ①肯定有BaCl2 ②肯定有MgCl2 ③肯定有NaHCO3 ④肯定有Na2CO3 ⑤肯定没有MgCl2 A. ①②③ B. ②④ C. ①③ D. ①③⑤ |
|
| 19. | 详细信息 |
向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如右图所示。下列结果不正确的是( )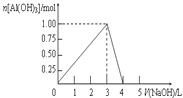 A. 反应过程中,沉淀最多时的质量为78g B. 反应过程中,Al3+离子有1/3转化为Al(OH) 3沉淀,则加入的NaOH溶液的体积可能为3.5L C. AlCl3溶液的浓度为2.0mol/L D. 当V(NaOH)=4.0 L时,得到的溶液中Na+、Cl-浓度一定不相等 |
|
| 20. | 详细信息 |
|
含氯化镁和氯化铝的200 mL 混合溶液中,c(Mg2+)为 0.2 mol?L-1,c(Cl-)为1.3 mol?L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol?L-1 NaOH溶液的体积为( ) A. 40 mL B. 72 mL C. 80 mL D. 128 mL |
|
| 21. | 详细信息 |
|
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热。请你根据所学知识回答下列问题: (1)上述反应中____是氧化剂,该反应中氧化产物与还原产物的物质的量之比为____。 (2)把氯气通入紫色石蕊溶液中,可以观察到的现象是:______________________。 (3)实验室配制好2.0 mol?L-1的NaOH溶液,需要这种溶液____mL才能与2.24 L氯气(标准状况)恰好完全反应。 (4)已知Br2的水溶液因浓度不同而呈现橙色或红棕色,NaBr溶液中缓缓通入Cl2时,可以看到无色溶液逐渐变为红棕色,请写出对应的离子方程式______________。 (5)现需490 mL 2.0 mol?L-1 NaOH溶液: ①所需称量的氢氧化钠固体的质量是____。 ②上述实验需要的仪器有天平(含砝码)、药匙、烧杯、量筒、玻璃棒、胶头滴管、______。 ③在配制溶液的过程中,下列操作可能造成结果偏高的是____。 A.定容时俯视 B.容量瓶不干燥,含有少量蒸馏水 C.溶解所用烧杯未洗涤 D.NaOH溶解后,未冷却即进行实验 |
|
| 22. | 详细信息 | ||||||||
目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见下表:
|
|||||||||
| 23. | 详细信息 |
实验室用下述装置制取氯气,并用氯气进行下列实验。看图回答下列问题: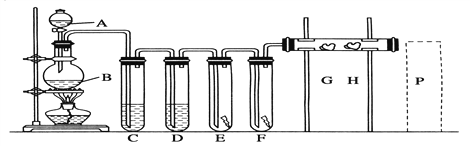 (1)A仪器的名称: ________。B中发生反应的离子方程式为_______________________。 (2)为了获得纯净干燥的氯气, C、D中应分别放入的试剂为C_________;D________。 (3)E中为红色干布条,F中为红色湿布条,可观察到的现象是_____________________。 (4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成__________________。 (5)整套装置存在不妥之处,请画出你认为应该补充的装置,并说明放置的位置_______________。 |
|
| 24. | 详细信息 |
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):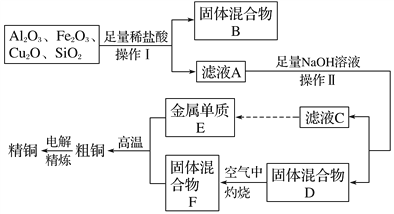 已知:Cu2O+2H+===Cu+Cu2++H2O。 (1)固体混合物B的成分是_________。它与NaOH溶液反应的离子方程式为_______________。 (2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子与Fe元素有关的离子反应方程式为_____________________,____________________________。设计要检验该铁元素的离子实验步骤为_____________________________________。 (3)在滤液C中通入足量CO2的离子方程式为________________。 |
|
最近更新



