邻水实验学校高一化学月考测验(2019年上期)免费试卷完整版
| 1. | 详细信息 |
|
以下命题,违背化学变化规律的是 ( ) A. 石墨制成金刚石 B. 煤加氢变成人造石油 C. 水变成汽油 D. 干冰转化成原子晶体 |
|
| 2. | 详细信息 |
下列仪器常用于物质分离的是( )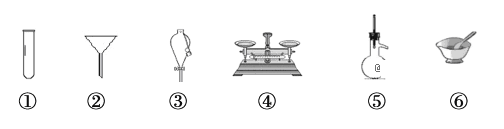 A. ③⑤⑥ B. ②③⑤ C. ②④⑤ D. ①②⑥ |
|
| 3. | 详细信息 |
草酸是“消字灵”的主要成分之一,其分子构成如图.下列关于草酸的叙述不正确的是( ) A. 草酸属于有机物 B. 草酸的化学式为H2C2O4 C. 一个草酸分子由2个氢原子、2个碳原子、4个氧原子构成 D. 草酸的摩尔质量为90 g |
|
| 4. | 详细信息 |
|
只用下列试剂中的一种就能鉴别Ba(NO3)2、Na2CO3、KCl三种溶液,该试剂是( ) A. Ca(NO3)2溶液 B. 稀H2SO4 C. NaOH溶液 D. Na2SO4溶液 |
|
| 5. | 详细信息 |
|
下列各组混合物中,能用分液漏斗进行分离的是( ) A. 酒精和水 B. 碘和四氯化碳 C. 水和四氯化碳 D. 汽油和植物油 |
|
| 6. | 详细信息 |
|
下列对实验过程的评价正确的是 A. 某固体中加入稀盐酸,产生了无色气体,证明该固体一定是碳酸盐 B. 某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42- C. 某无色溶液滴入无色酚酞试液显红色,该溶液一定显碱性 D. 验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含Cl- |
|
| 7. | 详细信息 |
|
下列实验操作中正确的是( ) A. 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 B. Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水池中,再用水冲入下水道 C. 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部蒸干才停止加热 D. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
|
| 8. | 详细信息 |
|
下列基本实验操作中,正确的是( ) A. 气体除杂 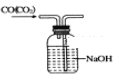 B. 收集氧气 B. 收集氧气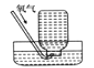 C. 稀释溶液 C. 稀释溶液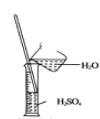 D. 滴加液体 D. 滴加液体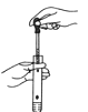 |
|
| 9. | 详细信息 |
|
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( ) A. 分液、蒸馏、萃取 B. 萃取、蒸发、分液 C. 分液、萃取、蒸馏 D. 蒸馏、萃取、分液 |
|
| 10. | 详细信息 |
|
下列叙述正确的是( ) A. 1 mol CO2的质量为44 g/mol B. H2SO4的摩尔质量为98 C. 标准状况下,气体摩尔体积约为22.4 L D. O2的相对分子质量为32 |
|
| 11. | 详细信息 |
|
下列分离或提纯物质的方法正确的是( ) A. 用蒸馏的方法制取蒸馏水 B. 用过滤的方法除去NaCl溶液中含有的少量Na2SO4 C. 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 D. 用加热、蒸发的方法可以除去NaCl中CaCl2、MgCl2等杂质 |
|
| 12. | 详细信息 |
|
通过分别加入AgNO3、Ba(NO3)2、Mg(NO3)2三种试剂,使某溶液中的Cl-、OH-、CO32-先后沉淀出来,逐一加以分离,则加入三种试剂的顺序是 A. AgNO3、Ba(NO3)2、Mg(NO3)2 B. Mg(NO3)2、Ba(NO3)2、AgNO3 C. Ba(NO3)2、AgNO3、Mg(NO3)2 D. Ba(NO3)2、Mg(NO3)2、AgNO3 |
|
| 13. | 详细信息 | ||||||||||||||||||||
下列除杂(括号内为杂质)的方法完全正确的是( )
|
|||||||||||||||||||||
| 14. | 详细信息 |
|
在相同温度和压强下,等质量的下列气体所占体积最大的是( ) A. H2 B. O2 C. CO2 D. Cl2 |
|
| 15. | 详细信息 |
|
下列各组物质中,所含分子数一定相同的是( ) A. 10 g H2和10 g O2 B. 5.6 L N2和5.6 L CO2 C. 14 g CO和0.5 mol Br2 D. 标准状况下2.24 L H2O和0.1 mol N2 |
|
| 16. | 详细信息 |
|
等物质的量的 SO2 和 SO3 相比较,下列结论错误的是 A. 它们的分子数目之比是 1∶1 B. 它们的氧原子数目之比为 2∶3 C. 它们的质量之比为 1∶1 D. 它们所含原子数目之比为 3∶4 |
|
| 17. | 详细信息 |
|
设阿伏加德罗常数为NA,则下列说法正确的是( ) A. 常温常压下,11.2 L甲烷中含有的氢原子数为2 NA B. 标准状况下,0.3 mol 二氧化硫中含有氧原子数为0.3 NA C. 常温下,2.7 g铝与足量的盐酸反应,失去电子数为0.3 NA D. 1 mol某气体体积约为22.4 L,则此时一定为标准状况。 |
|
| 18. | 详细信息 |
|
a mol H2 SO4 中含有b个氧原子,则阿伏加德罗常数可以表示为( ) A. a/4b mol -1 B. b/4a mol -1 C. a/b mol -1 D. b/a mol -1 |
|
| 19. | 详细信息 |
|
用NA表示阿伏加德罗常数,下列叙述正确的是( ) A. 标准状况下,22.4 L H2O含有的分子数为NA B. 常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02 NA C. 通常状况下,NA个CO2分子占有的体积为22.4 L D. 标准状况下,56 g Fe的体积约为22.4 L |
|
| 20. | 详细信息 |
|
已知RO32-的核内有x个中子,R的质量数为A,则m gRO32-含有电子的物质的量为( ) A. m(A+26-x)/(A+48) B. n(A-x-48)/(A+48) C. (A-x+50)/Am D. m(A-x+2)/A |
|
| 21. | 详细信息 |
|
按照阿伏加德罗定律,下列叙述不正确的 A. 同温同压下两种气体的体积之比等于物质的量之比 B. 同温同压下两种气体的物质的量之比等于密度之比 C. 同温同压下两种气体的密度之比等于摩尔质量之比 D. 同温同体积下两种气体的物质的量之比等于压强之比 |
|
| 22. | 详细信息 |
|
在一个密闭容器中盛有11gX气体(X的摩尔质量为44g/mol)时,压强为1×104Pa。如果在相同温度下,把更多的气体X充入容器,使容器内压强增至5×104Pa,这时容器内气体X的分子数约为 A. 3.3×1025 B. 3.3×1024 C. 7.5×1023 D. 7.5×1022 |
|
| 23. | 详细信息 |
|
NaHS、MgSO4、NaHSO4三种物质组成的混合物中,已知氧元素的质量分数为a%,则其中硫元素的质量分数为( ) A. a% B. 1-1.75% C. 4/7(1-a%) D. 3/7(1-a%) |
|
| 24. | 详细信息 |
|
(1)3.01×1023个OH−的物质的量为________mol,含有质子的物质的量为_____mol,含有电子的物质的量为________mol,这些OH−和________g Na+含有的电子数相同。 (2)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol−1。若阿伏加德罗常数用NA表示。 ①该气体的物质的量为________mol。 ②该气体所含原子总数为________个。 ③该气体在标准状况下的体积为________L。 ④该气体在标准状况下的密度为___________ g/L。 |
|
| 25. | 详细信息 |
|
粗盐中除含有Ca2+、Mg2+、SO (1)检验溶液中含有SO (2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。其中加入Na2CO3溶液的目的是___________________,滴加Na2CO3溶液时发生反应的化学方程式为________________________________________________________。 |
|
| 26. | 详细信息 |
I.下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: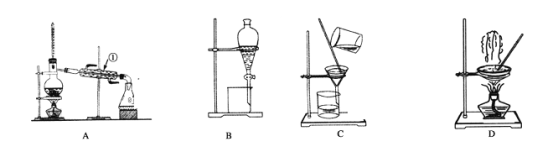 (1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中 的Cl-等杂质,选择装置________________。 (2)从碘水中分离出I2,选择装置________,该分离方法的名称为________________。 (3)装置A中①的名称是________,进水的方向是从________口进水。 II.某化学课外小组用海带为原料制取了少量碘水.现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液.其实验操作可分解为如下几步: A.把盛有溶液的分液漏斗放在铁架台的铁圈中; B.把50 mL碘水和15 mL CCl4加入分液漏斗中,并盖好玻璃塞; C.检验分液漏斗活塞和上口玻璃塞是否漏液; D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; E.放开活塞,用烧杯接收溶液; F.从分液漏斗上口倒出上层水溶液; G.将漏斗上口的玻璃塞打开,或使溶液上的凹槽或小孔对准漏斗口上的小孔; H.静置、分层. 就此实验,完成下列填空: (1)正确操作步骤的顺序是(用上述各操作的编号字母填空): ________→________→________→A→H→________→E→F._____________ (2)上述E步骤的操作中应注意______________________________________.上述G步骤操作的目的是_____________________________________________. (3)能选用CCl4从碘水中萃取碘的原因是______________________________________. (4)下列物质不能作为从溴水中萃取溴的溶剂是________. A.酒精 B.苯(一种有机溶剂,与水互不相溶,密度比水小) C.汽油 |
|
| 27. | 详细信息 |
|
有五瓶损坏标签的试剂,分别盛有硫酸溶液、氢氧化钾溶液、硝酸钡溶液、碳酸氢钠溶液、氯化铜溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E。观察发现,C试剂颜色为蓝色,其余为无色;几种试剂用小试管各取少量,两两相互滴加,反应现象为:A与C混合有蓝色沉淀,A与其余三种混合无明显现象,B与D出现白色沉淀,B与E无明显现象,D与E混合有气泡产生。 (1)由此,可判定下列试剂瓶中所盛试剂为(用主要成分的化学式表示):A___________,B___________,D___________,E___________, (2)请写出下面的化学方程式: ①B与D:___________________________________________; ②D与E:___________________________________________; ③A与C:___________________________________________; |
|
| 28. | 详细信息 |
|
取50.0mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后,得到沉淀14.51g,将沉淀用过量稀HNO3处理后,沉淀质量减少到4.66g,并有气体放出,试计算: (1)原溶液中Na2SO4的物质的量为______________; (2)生成气体的体积(标准状况)为_________________。 |
|
高中化学 试卷推荐
最近更新



