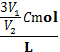2019й»‘йҫҷжұҹй«ҳдәҢдёӢеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺеёёжё©еёёеҺӢдёӢпјҢ4.6 g NO2ж°”дҪ“зәҰеҗ«жңү1.806Г—1023дёӘеҺҹеӯҗ BпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ80 g SO3жүҖеҚ зҡ„дҪ“з§ҜзәҰдёә22.4 L CпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4 L CCl4дёӯеҗ«жңүзҡ„CCl4еҲҶеӯҗж•°дёәNA DпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4 Lж°Ҝж°”дёҺи¶ійҮҸж°ўж°§еҢ–й’ жә¶ж¶ІеҸҚеә”пјҢиҪ¬з§»зҡ„з”өеӯҗж•°дёә2NA
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
иғҪиҜҙжҳҺBF3еҲҶеӯҗзҡ„4дёӘеҺҹеӯҗеңЁеҗҢдёҖе№ійқўзҡ„зҗҶз”ұжҳҜпјҲВ пјү AпјҺBвҖ”Fй”®зҡ„й”®и§’дёә120°                BпјҺBвҖ”Fй”®жҳҜйқһжһҒжҖ§й”® CпјҺ3дёӘBвҖ”Fй”®зҡ„й”®иғҪзӣёзӯүВ В В В В В В В В В В В В В В DпјҺ3дёӘBвҖ”Fй”®зҡ„й”®й•ҝзӣёзӯү
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
й…ҚеҲ¶дёҖе®ҡзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„NaOHжә¶ж¶Іж—¶пјҢеҜјиҮҙжө“еәҰеҒҸй«ҳзҡ„еҺҹеӣ еҸҜиғҪжҳҜВ (гҖҖгҖҖ) AпјҺе®№йҮҸ瓶зӣӣиҝҮNaOHжә¶ж¶ІпјҢдҪҝз”ЁеүҚжңӘжҙ—ж¶ӨВ В В BпјҺе®ҡе®№ж—¶д»°и§ҶеҲ»еәҰзәҝ CпјҺе®№йҮҸ瓶дёӯеҺҹжңүе°‘йҮҸзҡ„и’ёйҰҸж°ҙВ В В DпјҺ移液时пјҢдёҚж…Һе°Ҷж¶ІдҪ“жөҒеҲ°з“¶еӨ–
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
зҺ°жңүдёүз»„е®һйӘҢпјҡв‘ йҷӨеҺ»ж··еңЁжӨҚзү©жІ№дёӯзҡ„ж°ҙ в‘Ўе°Ҷжө·ж°ҙеҲ¶жҲҗж·Ўж°ҙ в‘ўз”ЁйЈҹз”Ёй…’зІҫжөёжіЎдёӯиҚүиҚҜжҸҗеҸ–е…¶дёӯзҡ„жңүж•ҲжҲҗд»ҪгҖӮдёҠиҝ°еҲҶзҰ»ж–№жі•дҫқж¬ЎжҳҜ(гҖҖгҖҖ) AпјҺеҲҶж¶ІгҖҒиҗғеҸ–гҖҒи’ёйҰҸВ В В BпјҺиҗғеҸ–гҖҒи’ёйҰҸгҖҒеҲҶж¶І CпјҺеҲҶж¶ІгҖҒи’ёйҰҸгҖҒиҗғеҸ–В В В DпјҺи’ёйҰҸгҖҒиҗғеҸ–гҖҒеҲҶж¶І
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
иӢҘеҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗжҺ’еёғдёәns1зҡ„е…ғзҙ Rзҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺдёҖе®ҡжҳҜв… Aж—Ҹе…ғзҙ BпјҺдёҖе®ҡжҳҜйҮ‘еұһе…ғзҙ CпјҺеҸҜиғҪдёҚжҳҜйҮ‘еұһе…ғзҙ д№ҹеҸҜиғҪжҳҜйқһйҮ‘еұһе…ғзҙ DпјҺдёҚжҳҜв…ЎAж—Ҹе…ғзҙ е°ұжҳҜеүҜж—Ҹе…ғзҙ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁжҹҗж— иүІйҖҸжҳҺжә¶ж¶ІдёӯпјҢиғҪеӨ§йҮҸе…ұеӯҳзҡ„зҰ»еӯҗз»„жҳҜ(гҖҖгҖҖ) AпјҺKпјӢгҖҒMnO4вҖ”гҖҒSO42вҖ”В В В В В В В В В В В В В В В В В В В В В BпјҺAl3пјӢгҖҒClвҖ”гҖҒSO42вҖ” CпјҺNaпјӢгҖҒCH3COOвҖ”гҖҒHпјӢВ В В В В В В В В В В В В В В В В В В В DпјҺOHвҖ”гҖҒNaпјӢгҖҒFe3пјӢ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺй“ҒдёҺзӣҗй…ёеҸҚеә”пјҡ2Fe пјӢ 6HпјӢ пјқ 2Fe3пјӢ пјӢ 3H2вҶ‘ BпјҺж°ўж°§еҢ–й’ЎдёҺзЎ«й…ёй“ңжә¶ж¶Іж··еҗҲпјҡ2OH- + Cu2+ =В CuпјҲOHпјү2вҶ“ CпјҺиҝҮйҮҸNaHCO3жә¶ж¶Іе’Ңе°‘йҮҸBa(OH)2еҸҚеә”пјҡ2HCO3-пјӢBa2+пјӢ2OH-=BaCO3вҶ“пјӢCO32-пјӢ2H2O DпјҺзҹізҒ°д№іе’Ңзӣҗй…ёеҸҚеә”пјҡCaCO3пјӢ2H+пјқCa2+пјӢCO2вҶ‘пјӢH2O
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—ж··еҗҲзү©зҡ„еҲҶзҰ»ж–№жі•дёҚеҸҜиЎҢзҡ„жҳҜВ (гҖҖгҖҖ) AпјҺдә’жә¶зҡ„ж¶ІдҪ“ж··еҗҲзү©еҸҜд»Ҙз”ЁеҲҶж¶Ізҡ„ж–№жі•иҝӣиЎҢеҲҶзҰ» BпјҺдә’дёҚзӣёжә¶зҡ„ж¶ІдҪ“ж··еҗҲзү©еҸҜд»Ҙз”ЁеҲҶж¶Ізҡ„ж–№жі•иҝӣиЎҢеҲҶзҰ» CпјҺжІёзӮ№дёҚеҗҢзҡ„ж··еҗҲзү©еҸҜд»Ҙз”Ёи’ёйҰҸзҡ„ж–№жі•иҝӣиЎҢеҲҶзҰ» DпјҺеҸҜжә¶дәҺж°ҙзҡ„еӣәдҪ“дёҺйҡҫжә¶дәҺж°ҙзҡ„еӣәдҪ“зҡ„ж··еҗҲзү©еҸҜз”Ёжә¶и§ЈгҖҒиҝҮж»Өзҡ„ж–№жі•иҝӣиЎҢеҲҶзҰ»
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зҰ»еӯҗдёӯпјҢеӣ еҸ‘з”ҹж°§еҢ–иҝҳеҺҹеҸҚеә”иҖҢдёҚиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ(гҖҖгҖҖ) AпјҺFe3+гҖҒH+гҖҒSO42пјҚгҖҒClO-В В В В В В В В В В В В В BпјҺFe3+гҖҒFe2+гҖҒSO42пјҚгҖҒNO3- CпјҺAl3+гҖҒNa+гҖҒSO42пјҚгҖҒCO32пјҚВ В В В В В В В В В В В DпјҺK+гҖҒH+гҖҒBr-гҖҒMnO4-
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
е®һйӘҢдёӯйңҖ2mol/Lзҡ„NaClжә¶ж¶І950mLпјҢй…ҚеҲ¶ж—¶еә”йҖүз”Ёзҡ„е®№йҮҸ瓶зҡ„и§„ж је’Ңз§°еҸ–NaClзҡ„иҙЁйҮҸеҲҶеҲ«: AпјҺ1000mLпјҢ117gВ В В В В В В В В BпјҺ950mLпјҢ111пјҺ2 gВ В В В CпјҺд»»ж„Ҹи§„ж јпјҢ117gВ В В В В В В DпјҺ500mLпјҢ111пјҺ2g
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘ3.01Г—1023дёӘXж°”дҪ“еҲҶеӯҗзҡ„иҙЁйҮҸдёә8 gпјҢеҲҷXж°”дҪ“зҡ„ж‘©е°”иҙЁйҮҸжҳҜ(гҖҖгҖҖ) AпјҺ16 gВ В В BпјҺ32 gВ В В CпјҺ64 g/molВ В В DпјҺ16 g /mol
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°пјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺ2.0gйҮҚж°ҙпјҲD2Oпјүдёӯеҗ«жңүзҡ„дёӯеӯҗж•°дёәNA BпјҺ50 mL 12 molВ·Lп№Ј1зӣҗй…ёдёҺи¶ійҮҸMnO2е…ұзғӯпјҢиҪ¬з§»зҡ„з”өеӯҗж•°дёә0.3NA CпјҺ23gйҮ‘еұһй’ еҸҳдёәй’ зҰ»еӯҗж—¶еӨұеҺ»зҡ„з”өеӯҗж•°дёәNA DпјҺеёёжё©еёёеҺӢдёӢпјҢ48gO3е’ҢO2ж··еҗҲж°”дҪ“дёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•°дёә3NA
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺNaClжә¶ж¶ІеңЁз”өжөҒдҪңз”ЁдёӢз”өзҰ»жҲҗNaпјӢдёҺClпјҚ BпјҺжә¶дәҺж°ҙеҗҺиғҪз”өзҰ»еҮәHпјӢзҡ„еҢ–еҗҲзү©йғҪжҳҜй…ё CпјҺж°ҜеҢ–ж°ўжә¶дәҺж°ҙиғҪеҜјз”өпјҢдҪҶж¶ІжҖҒж°ҜеҢ–ж°ўдёҚиғҪеҜјз”ө DпјҺзЎ«й…ёй’Ўйҡҫжә¶дәҺж°ҙпјҢжүҖд»ҘзЎ«й…ёй’ЎжҳҜйқһз”өи§ЈиҙЁ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷи¶ійҮҸHClйҖҡе…ҘдёӢиҝ°еҗ„жә¶ж¶ІдёӯпјҢжүҖеҗ«зҰ»еӯҗиҝҳиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ(гҖҖгҖҖ) AпјҺKпјӢгҖҒSO32пјҚгҖҒClпјҚгҖҒNO3пјҚ BпјҺHпјӢгҖҒNH4пјӢгҖҒAl3пјӢгҖҒSO42пјҚ CпјҺNaпјӢгҖҒS2пјҚгҖҒOHпјҚгҖҒSO42пјҚ DпјҺNaпјӢгҖҒCa2пјӢгҖҒCH3COOпјҚгҖҒHCO3пјҚ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҝҮзЁӢжІЎжңүж¶үеҸҠеҢ–еӯҰеҸҳеҢ–зҡ„жҳҜ(В В В ) AпјҺз©әж°”ж¶ІеҢ–В В В BпјҺжҳҺзҹҫеҮҖж°ҙВ В В CпјҺжө·еёҰжҸҗзўҳВ В В DпјҺз…Өзҡ„ж¶ІеҢ–
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°дёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺNa+гҖҒMg2+гҖҒAl3+зҡ„ж°§еҢ–жҖ§дҫқж¬ЎеҮҸејұ BпјҺRbOHгҖҒKOHгҖҒMg(OH)2зўұжҖ§дҫқж¬ЎеҮҸејұ CпјҺH2SгҖҒH2OгҖҒHFзҡ„зЁіе®ҡжҖ§дҫқж¬Ўеўһејә DпјҺO2-гҖҒF-гҖҒNa+гҖҒBr-зҡ„еҚҠеҫ„еӨ§е°ҸйЎәеәҸдёәпјҡBr->O2->F->Na+
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁзҡ„зҶ”зӮ№й«ҳдҪҺйЎәеәҸпјҢжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺйҮ‘еҲҡзҹіпјһжҷ¶дҪ“зЎ…пјһзўіеҢ–зЎ…В В BпјҺKпјһNaВ В В CпјҺNaFпјңNaClпјңNaBrВ В В В В В В В DпјҺCI4пјһCBr4
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯпјҢжңүжһҒжҖ§е…ұд»·й”®зҡ„жҳҜпјҲВ В пјү AпјҺеҚ•иҙЁзўҳВ В В В В В В В В В BпјҺж°ҜеҢ–й•ҒВ В В В В В В В В В CпјҺжәҙеҢ–й’ҫВ В В В В В В В В В DпјҺж°ҙ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗҢе‘ЁжңҹжңүдёӢеҲ—з”өеӯҗжҺ’еёғејҸзҡ„еҺҹеӯҗдёӯпјҢ第дёҖз”өзҰ»иғҪжңҖе°Ҹзҡ„жҳҜ AпјҺns2np3В В В BпјҺns2np4 CпјҺns2np5В В В DпјҺns2np6
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
еҪ“зўіеҺҹеӯҗзҡ„ж ёеӨ–з”өеӯҗжҺ’еёғз”ұ1s22s22p2иҪ¬еҸҳдёә1s22s12p3ж—¶пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺзўіеҺҹеӯҗз”ұеҹәжҖҒеҸҳдёәжҝҖеҸ‘жҖҒВ В В BпјҺзўіеҺҹеӯҗз”ұжҝҖеҸ‘жҖҒеҸҳдёәеҹәжҖҒ CпјҺиҜҘиҝҮзЁӢе°Ҷдә§з”ҹеҸ‘е°„е…үи°ұВ В В DпјҺзўіеҺҹеӯҗиҰҒеҗ‘еӨ–з•ҢзҺҜеўғйҮҠж”ҫиғҪйҮҸ
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„ж•°еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺеёёжё©еёёеҺӢдёӢпјҢ5.6LO2еҗ«жңү4NAдёӘз”өеӯҗ BпјҺ28gN2гҖҒCOе’ҢC2H4зҡ„ж··еҗҲж°”дҪ“еҲҶеӯҗжҖ»ж•°дёәNA CпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4Lзӣҗй…ёеҗ«жңүNAдёӘHClеҲҶеӯҗ DпјҺ1molNaиў«е®Ңе…Ёж°§еҢ–з”ҹжҲҗNa2O2пјҢеӨұеҺ»2NAдёӘз”өеӯҗ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
е°ҶC mol/Lзҡ„AlCl3жә¶ж¶ІV1mLеҠ ж°ҙзЁҖйҮҠиҮіV2mLпјҢзЁҖйҮҠеҗҺжә¶ж¶ІдёӯCl-зү©иҙЁзҡ„йҮҸжө“еәҰдёә ( В ) AпјҺ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүе…іжҷ¶дҪ“зҡ„дёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„з»„еҗҲжҳҜ в‘ жҷ¶дҪ“дёӯеҲҶеӯҗй—ҙдҪңз”ЁеҠӣи¶ҠеӨ§пјҢеҲҶеӯҗи¶ҠзЁіе®ҡВ в‘ЎпјҺеҺҹеӯҗжҷ¶дҪ“дёӯе…ұд»·й”®и¶ҠејәпјҢзҶ”зӮ№и¶Ҡй«ҳ в‘ўеҶ°зҶ”еҢ–ж—¶ж°ҙеҲҶеӯҗдёӯе…ұд»·й”®еҸ‘з”ҹж–ӯиЈӮВ в‘ЈпјҺж°ҜеҢ–й’ зҶ”еҢ–ж—¶зҰ»еӯҗй”®жңӘиў«з ҙеқҸ в‘ӨзҶ”еҢ–ж—¶ж— йңҖз ҙеқҸеҢ–еӯҰй”®зҡ„жҷ¶дҪ“дёҖе®ҡжҳҜеҲҶеӯҗжҷ¶дҪ“В в‘ҘпјҺе…ғзҙ е‘ЁжңҹиЎЁд»Һв…ўBж—ҸеҲ°в…ЎBж—Ҹ8дёӘзәөиЎҢзҡ„е…ғзҙ йғҪжҳҜйҮ‘еұһе…ғзҙ в‘ҰпјҺеңЁ SiO2е’Ңе№ІеҶ°жҷ¶дҪ“дёӯпјҢйғҪеӯҳеңЁеҚ•дёӘеҲҶеӯҗ⑧пјҺеҲҶеӯҗжҷ¶дҪ“дёҚйғҪжҳҜе…ұд»·еҢ–еҗҲзү© В В В AпјҺв‘ в‘Ўв‘ӨВ В В В В В В BпјҺв‘Ўв‘Јв‘ӨВ В В В В В В В В В В CпјҺв‘Ўв‘Ө⑧         DпјҺв‘ в‘Јв‘Ұ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
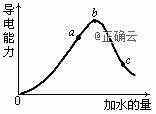
еңЁдёҖе®ҡжё©еәҰдёӢпјҢеҶ°йҶӢй…ёеҠ ж°ҙзЁҖйҮҠиҝҮзЁӢдёӯжә¶ж¶Ізҡ„еҜјз”өиғҪеҠӣеҰӮдёӢеӣҫжүҖзӨәпјҢиҜ·еӣһзӯ”пјҡ
пјҲ1пјүеҶҷеҮәйҶӢй…ёзҡ„з”өзҰ»ж–№зЁӢејҸ___________________________________________гҖӮ пјҲ2пјүaгҖҒbгҖҒcдёүзӮ№жә¶ж¶Ідёӯж°ўзҰ»еӯҗжө“еәҰз”ұе°ҸеҲ°еӨ§зҡ„йЎәеәҸдёә__________________ гҖӮ пјҲ3пјүaгҖҒbгҖҒcдёүзӮ№дёӯйҶӢй…ёзҡ„з”өзҰ»зЁӢеәҰжңҖеӨ§зҡ„жҳҜ_________гҖӮ пјҲ4пјүеҸ–з”ІгҖҒд№ҷдёӨд»ҪзӯүдҪ“з§ҜcзӮ№зҡ„жә¶ж¶ІпјҢз”Із”Ёи’ёйҰҸж°ҙзЁҖйҮҠ10еҖҚпјҢд№ҷз”Ёи’ёйҰҸж°ҙзЁҖйҮҠ100еҖҚпјҢеҲҷзЁҖйҮҠеҗҺз”ІгҖҒд№ҷдёӨжә¶ж¶Ідёӯзҡ„H+жө“еәҰпјҡC(H+)з”І_____ 10C(H+)д№ҷпјҲеЎ«вҖңеӨ§дәҺвҖқгҖҒвҖңе°ҸдәҺвҖқжҲ– вҖңзӯүдәҺвҖқпјү пјҲ5пјүйҶӢй…ёдёҺж°Ёж°ҙеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ__________________ гҖӮ
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
AгҖҒBгҖҒCгҖҒDгҖҒEдә”з§Қе…ғзҙ ,е®ғ们зҡ„ж ёз”өиҚ·ж•°дҫқж¬ЎеўһеӨ§,дё”йғҪе°ҸдәҺ20гҖӮе…¶дёӯCгҖҒEжҳҜйҮ‘еұһе…ғзҙ ;Aе’ҢEеұһеҗҢж—Ҹ,е®ғ们еҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗжҺ’еёғејҸдёәns1гҖӮBе’ҢDд№ҹеұһеҗҢж—Ҹ,е®ғ们еҺҹеӯҗжңҖеӨ–еұӮзҡ„pиғҪзә§з”өеӯҗж•°жҳҜsиғҪзә§з”өеӯҗж•°зҡ„дёӨеҖҚгҖӮCеҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°зӯүдәҺDеҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°зҡ„дёҖеҚҠгҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳ: (1)еҶҷеҮәCе…ғзҙ еҹәжҖҒеҺҹеӯҗзҡ„з”өеӯҗжҺ’еёғејҸ:В ________________В гҖӮВ (2)з”Ёз”өеӯҗжҺ’еёғеӣҫиЎЁзӨәDе…ғзҙ еҺҹеӯҗзҡ„д»·з”өеӯҗ:__________гҖӮВ (3)е…ғзҙ BдёҺDзҡ„з”өиҙҹжҖ§зҡ„еӨ§е°Ҹе…ізі»жҳҜB___ D (еЎ«вҖң>вҖқвҖң<вҖқжҲ–вҖң=вҖқ,дёӢеҗҢ), EдёҺCзҡ„第дёҖз”өзҰ»иғҪеӨ§е°Ҹе…ізі»жҳҜE____CгҖӮ (4)еҶҷеҮәе…ғзҙ Eе’ҢCзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©д№Ӣй—ҙеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ _________________________________________гҖӮ
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||
|
aгҖҒbгҖҒcгҖҒdгҖҒeеқҮдёәе‘ЁжңҹиЎЁеүҚеӣӣе‘Ёжңҹе…ғзҙ пјҢеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§пјҢзӣёе…ідҝЎжҒҜеҰӮдёӢиЎЁжүҖзӨәгҖӮ
иҜ·еӣһзӯ”пјҡ пјҲ1пјүcеұһдәҺ_____________еҢәзҡ„е…ғзҙ гҖӮ пјҲ2пјүbдёҺе…¶еҗҢе‘ЁжңҹзӣёйӮ»е…ғзҙ 第дёҖз”өзҰ»иғҪз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёә______________пјҲз”Ёе…ғзҙ з¬ҰеҸ·иЎЁзӨәпјүгҖӮ пјҲ3пјүиӢҘе°Ҷaе…ғзҙ жңҖй«ҳд»·ж°§еҢ–зү©ж°ҙеҢ–зү©еҜ№еә”зҡ„жӯЈзӣҗй…ёж №зҰ»еӯҗиЎЁзӨәдёәAпјҢеҲҷAзҡ„дёӯеҝғеҺҹеӯҗзҡ„иҪЁйҒ“жқӮеҢ–зұ»еһӢдёә_____________пјҢAзҡ„з©әй—ҙжһ„еһӢдёә____________________пјӣ пјҲ4пјүd зҡ„жҹҗж°§еҢ–зү©жҷ¶дҪ“з»“жһ„еҰӮеӣҫ,жҜҸдёӘйҳҙзҰ»еӯҗе‘Ёеӣҙзӯүи·қзҰ»дё”жңҖиҝңзҡ„йҳҙзҰ»еӯҗж•°дёә_______________;еңЁe2+зҰ»еӯҗзҡ„ж°ҙжә¶ж¶ІдёӯйҖҗж»ҙж»ҙеҠ bзҡ„ж°ўеҢ–зү©ж°ҙжә¶ж¶ІиҮіиҝҮйҮҸпјҢеҸҜи§ӮеҜҹеҲ°зҡ„зҺ°иұЎдёә________________гҖӮ
|
|||||||||||
- иҘҝи—ҸжӢүиҗЁдёӯеӯҰ2020-2021е№ҙй«ҳдәҢдёҠеҚҠе№ҙ第дәҢж¬ЎжңҲиҖғзҗҶз»јеҢ–еӯҰйўҳеёҰеҸӮиҖғзӯ”жЎҲ
- жІіеҢ—й«ҳдәҢеҢ–еӯҰ2019е№ҙдёҠеҶҢжңҲиҖғжөӢйӘҢе…Қиҙ№жЈҖжөӢиҜ•еҚ·
- йҫҷжө·еёӮ2018е№ҙй«ҳдёүдёҠеҶҢеҢ–еӯҰжңҲиҖғжөӢйӘҢеңЁзәҝе…Қиҙ№иҖғиҜ•
- ж№ҳиөЈзҡ–еҚҒдә”ж Ў2020еұҠй«ҳдёүдёӢеҚҠе№ҙ第дёҖж¬ЎиҒ”иҖғиҖғиҜ•еҢ–еӯҰиҖғиҜ•
- 2019-2020е№ҙй«ҳдәҢдёҠеҶҢжңҹдёӯиҖғиҜ•еҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲж№–еҢ—зңҒе®ңжҳҢеёӮй•ҝйҳіеҺҝ第дёҖй«ҳзә§дёӯеӯҰпјү
- 2019еұҠй«ҳдёүдёҠеҚҠжңҹжңҹжң«иҒ”иҖғзҗҶ科综еҗҲеҢ–еӯҰиҖғйўҳпјҲеҶ…и’ҷеҸӨиҮӘжІ»еҢәй„Ӯе°”еӨҡж–ҜиҘҝйғЁеӣӣж——пјү
- 2018иҮі2019е№ҙй«ҳдёҖдёӢеӯҰжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҜ•еҚ·е®Ңж•ҙзүҲпјҲеҶ…и’ҷеҸӨиҮӘжІ»еҢәжқӯй”ҰеҗҺж——еҘӢж–—дёӯеӯҰпјү
- еӨ©ж°ҙдёҖдёӯ2020е№ҙй«ҳдёҖеҢ–еӯҰдёҠжңҹжңҹжң«иҖғиҜ•иҜ•еҚ·еёҰи§ЈжһҗеҸҠзӯ”жЎҲ
 В В В B
В В В B В В В C
В В В C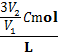 В В В D
В В В D