2019浙江高一下学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
下列属于氧化物的是 A. NaCl B. Al2O3 C. H2SO4 D. NaOH
|
|
| 2. | 详细信息 |
|
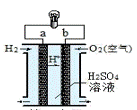
如图所示,水槽中试管内有一枚铁钉,放置数天后观察:
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于________腐蚀。(填“化学”或“电化学”) (2)若试管内液面上升,则原溶液呈________性,发生_______腐蚀,电极反应式:负极:__________,正极:________________。 (3)若试管内液面下降,则原溶液呈_______性,发生________腐蚀,电极反应式:负极:_________,正极:____________。
|
|
| 3. | 详细信息 |
|
.下列仪器名称为“长颈漏斗”的是 A.
|
|
| 4. | 详细信息 |
|
下列物质的水溶液能导电,但属于非电解质的是 A. CH3CH2OH B. 盐酸 C. CO2 D. Na
|
|
| 5. | 详细信息 |
|
下列物质的水溶液因溶质水解显酸性的是 A. KNO3 B. NH4Cl C. NaHSO4 D. NaHCO3
|
|
| 6. | 详细信息 |
|
下列物质的主要成分为甲烷的是 A. 干冰 B. 可燃冰 C. 水煤气 D. 液化石油气
|
|
| 7. | 详细信息 |
|
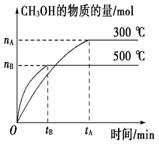
下列表示正确的是 A. 丙烷分子的比例模型为: B. 乙炔的结构简式:CHCH C. 乙炔分子的球棍模型: D. 聚丙烯的结构简式:
|
|
| 8. | 详细信息 |
|
乙烯是重要的工业原料,下列有关乙烯叙述不正确的是 A. 常温常压下是气体 B. 能使溴的四氯化碳溶液褪色 C. 可使酸性高锰酸钾溶液发生加成反应而褪色 D. 在氧气中燃烧有明亮的火焰
|
|
| 9. | 详细信息 |
|
下列说法不正确的是 A. 石油的裂化、裂解都是从长链烃变成短链烃 B. 裂化目的是获得轻质油,裂解目的是获得气态乙烯、丙烯等短链烃 C. 石油经过常、减压分馏及裂化等工序炼制后即能得到纯净物 D. 石油分馏是物理变化,裂化裂解是化学变化
|
|
| 10. | 详细信息 |
|
欲制取较纯净的CH2ClCH2Cl(即1,2-二氯乙烷),最合理的方法是 A. CH3CH3与Cl2取代 B. CH2=CH2与 HCl加成 C. CH2=CH2与Cl2加成 D. CH3CH2Cl与Cl2取代
|
|
| 11. | 详细信息 |
|
.下列说法正确的是 A. 石墨和C60互 C. l4CO2的摩尔质量为46 D.
|
|
| 12. | 详细信息 |
|
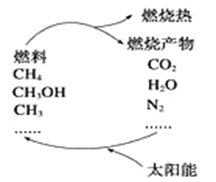
有专家提出,如果对燃烧产物如CO2、H2O、N2 等利用太阳能使它们重新组合,使之变成CH4、CH3OH、NH3等的构思(如图)能够实现,那么不仅可以消除对大气的污染,还可以节约燃料, 缓解能源危机,在此过程中太阳能最终转化为
A. 化学能 B. 生物质能 C. 热能 D. 电能
|
|
| 13. | 详细信息 |
|
城市居民用的石油气主要成分是丁烷,在使用的过程中,常有一些杂质以液态沉积于钢瓶中, 这种杂质是 A. 丙烷和丁烷 B. 乙烷和丙烷 C. 乙烷和戊烷 D. 戊烷和己烷
|
|
| 14. | 详细信息 |
|
一定温度下,反应N2(g)+3H2(g) 2NH3(g)达到化学平衡状态的标志是 A. c(N2)∶c(H2)∶c(NH3)=1∶3∶2 B. N2、H2和NH3的物质的量分数不再改变 C. N2与H2的物质的量之和是NH3的物质的量2倍 D. 单位时间里每增加1molN2,同时增加3molH2
|
|
| 15. | 详细信息 |
|
.除去甲烷中混有的乙烯 A. 酸性高锰酸钾溶液 B. 溴水 C. 溴的四氯化碳溶液 D. 氢氧化钠溶液
|
|
| 16. | 详细信息 |
|
氢氧燃料电池是一种常见化学电源,其原理反应:2H2+O2=2H2O,其工作示意图如图。下列说法不正确的是
A. a 极是负极 B. b 电极上发生还原反应 C. 正极的电极反应式为:O2+2H2O+4e-=OH- D. 放电前后电解质溶液的pH发生改变
|
|
| 17. | 详细信息 |
|
.已知空气—锌电池的电极反应如下: 锌片电极:Zn+2OH--2e-=ZnO+H2O,石墨电极: A. 负极,发生还原反应 B. 正极,发生氧化反应 C. 负极,发生氧化反应 D. 正极,发生还原反应
|
|
| 18. | 详细信息 |
|
下列说法中正确的是 A. 镍氢电池、锂电池和碱性锌锰干电池都是二次电池 B. 氢氧燃料电池是一种高效且不会污染环境 C. 铅蓄电池放电的时候正极材料是铅,负极材料是二氧化铅 D. 铅蓄电池充电时将化学能转化为电能
|
|
| 19. | 详细信息 |
|
.在一定温度下,反应H2(g)+I2(g) A. 单位时间内生成nmolH2,同时就有nmolHI 生成 B. 单位时间内有nmolH2生成,同时就有nmolI2生成 C. 容器内气体的总压强不随时间的变化而变化 D. 容器内混合气体的颜色不再变化
|
|
| 20. | 详细信息 |
|
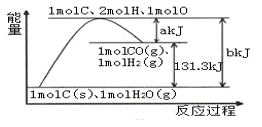
根据能量变化示意图,下列说法正确的是
A. 反应物的总能量高于生成物的总能量 B. 2molH和1molO结合生成1molH2O放出热量 C. 1molC和1molH2O反应生成1molCO和1molH2,需要吸收131.3kJ的热量 D. 反应的热化学方程式可表示为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+(a-b)kJ·mol-1
|
|
| 21. | 详细信息 |
|
将 pH=1的盐酸与pH=11的NaOH 溶液按体积比为1:9 混合,混合后溶液的pH约为 A. 2 B. 6 C. 7 D. 10
|
|
| 22. | 详细信息 |
|
.下列关于电解质溶液的说法正确的是 A. 25℃时,某浓度的KHA溶液pH=4,则HA-的电离程度大于水解程度,H2A为弱酸 B. 常温下,通过测定0.1mol•L-1NH4Cl溶液的酸碱性能证明NH3•H2O是弱电解质 C. 同浓度的盐酸和醋酸稀释相同倍数后,盐酸的pH大于醋酸 D. pH=3的CH3COOH 溶液与pH=11的NaOH溶液等体积混合,所得混合溶液中:c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
|
|
| 23. | 详细信息 |
|
铜是人类最早发现和使用的金属之一,铜及其合金的用途广泛。粗铜中含有少量铁、锌、镍、 银、金等杂质,工业上可用电解法精炼粗铜制得纯铜,下列叙述正确的是(已知氧化性:Fe2+<Ni2+<Cu2+) A. 粗铜作阳极,其电极反应式:Cu2++2e-=Cu B. 电解过程中,电解质溶液中c(Cu2+)不变 C. 电解后,阴极上还附有极少量的Fe和Ni D. 电解后,可用阳极泥来提炼金、银等贵金属
|
|
| 24. | 详细信息 |
|
.相同材质的铁在下列情形下最不易被腐蚀的是 A. C.
|
|
| 25. | 详细信息 |
|
.常温下,关于pH值相同的醋酸和盐酸两种溶液,下列说法不正确的是 A. c(CH3COOH)>c(HCl) B. c(CH3COO-)= c(Cl-)=c(H+) C. 两种溶液中水的电离程度相同 D. 与等浓度的氢氧化钠溶液反应,醋酸消耗的体积少
|
|
| 26. | 详细信息 |
|
下列叙述正确的是 A. 95℃纯水的pH<7,说明加热可导致水呈酸性 B. pH=3的醋酸溶液,稀释至10倍后pH=4 C. 0.2mol·L-1的盐酸与等体积水混合后pH=1 D. pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
|
|
| 27. | 详细信息 | |||||||||||||||||||||
|
反应X(g)
下列有关该反应的描述正确的是 A. 在200℃时,4min内用Y表示的化学反应速率为0.1125mol·L-1·min-1 B. T℃下,6min时反应刚好达到平衡状态 C. 根据上表内 X 的浓度变化,可知浓度越大,反应速率越大 D. 从表中可以看出T <200
|
||||||||||||||||||||||
| 28. | 详细信息 |
|
在一密闭容器中充入1 molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g) A. 保持容器容积不变,向其中加入1molH2,化学反应速率不变 B. 保持容器容积不变,向其中加入1molAr,化学反应速率增大 C. 保持容器内气体压强不变,向其中加入1molAr,化学反应速率不变 D. 保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),化学反应速率不变
|
|
| 29. | 详细信息 |
|
下列条件一定能使反应速率加快的是 ①增加反应物的物质的量②升高温度③缩小反应容器的体积④加入生成物⑤加入MnO2 A. 全部 B. ①②⑤ C. ② D. ②③
|
|
| 30. | 详细信息 |
|
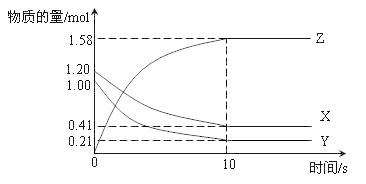
. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是
A. 反应开始到10s,用Z表示的反应速率为0.158 mol·L-1·s-1 B. 10s后,该反应停止进行 C. 反应的化学方程式为:2X(g) + Y(g) D. 反应开始到10s时,平均反应速率:v(X)=" v(Y)=0.0395" mol·L-1·s-1
|
|
| 31. | 详细信息 |
|
.根据如图所示的信息,判断下列叙述不正确的是
A. 1mol氢气的共价键形成放出436kJ能量 B. 氢气跟氧气反应生成水的同时吸收能量 C. 1molH2(g)跟 D. 1molH(g)与
|
|
| 32. | 详细信息 |
|
下面列出了几组物质,请将物质的合适组号填写在空格上。 同位素_____________,同素异形体__________,同分异构体_________________。 ①金刚石与“足球烯”C60;②D与T;③16O、17O和18O;④氧气(O2)与臭氧(O3);⑤CH4和CH3CH2CH3;⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑦
|
|
| 33. | 详细信息 |
|
(1)常温下,0.5mol 甲醇(CH3OH)在氧气中完全燃烧生成CO2和液态水,放出热 量363.3kJ。写出该反应的热化学方程式_____________。 (2)请设计一个燃料电池:电解质溶液为强碱溶液,Pt 作电极,在电极上分别通入CO和氧气。通入 CO的电极应为_______极(填“正”或“负”),该电极上发生的电极反应式为___________。
|
|
| 34. | 详细信息 |
|
一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)
(1)该反应的平衡常数表达式K=_______; (2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表 示的化学反应速率是______(用 nB,tB表示)。 (3)判断该可逆反应达到化学平衡状态的标志是_________(填字母,下同)。 a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变 c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
|
|
| 35. | 详细信息 |
|
常温下,现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题: (1)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为: pH(甲)___________pH(乙)(填“大于”、“小于”或“等于”)。 (2)各取25mL的甲、乙两溶液,分别用等浓度的 NaOH 稀溶液中和至 pH=7,则消耗的 NaOH 溶 液的体积大小关系为:V(甲)_____________V(乙)(填“大于”、“小于”或“等于”)。 (3)pH=2的醋酸溶液中由水电离出的c(H+)________0.01mol/LHCl溶液中由水电离出的c(H+)。(填“>”、“<”、或“=”)
|
|
| 36. | 详细信息 |
|
将气体A、B置于固定容积为2L (1)用C 表示10s内反应的平均反应速率为____________。 (2)反应前A的物质的量浓度是_______________。 (3)10s末,生成物D的浓度为______________________。 (4)A 平衡转化率______________。
|
|
| 37. | 详细信息 |
|
某烃分子中,碳、氢元素的质量比为5:1,相对分子质量为72。写出该烃的分子式及所有的同分异构体并用系统命名法命名。________________
|
|
| 38. | 详细信息 |
|
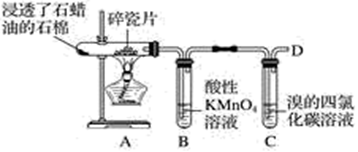
37.如图是石蜡油在炽热碎瓷片的作用下产生乙烯,并检验乙烯性质的实验。
回答下列问题: (1)从装置 A 中出来的气体中含有烷烃和___________。 (2)B中酸性高锰酸钾溶液________,这是因为生成的气体被________(填“氧化”或“还原”), 反应类型为___________。 (3)C中溴的四氯化碳溶液___________,发生反应的化学方程式:_________,反应类型为___________。 (4)在D处点燃之前必须进行的操作是________,燃烧时反应的化学方程式为____________。
|
|
 B.
B. 
 D.
D. 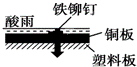

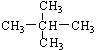 和
和