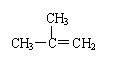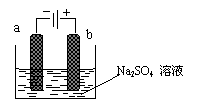2017й«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁеұһдәҺзғғзұ»зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В (В В В ) В В В A. CH3ClВ В В В В B. C2H5OHВ В В В В В В В В C. COВ В В В В В В D. CH4
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„еҢ–еҗҲзү©дёӯпјҢйҖҡејҸзӣёеҗҢзҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В (В В В ) A. зҺҜзғ·зғғгҖҒзӮ”зғғВ В В В В В В В В В В В В В В B. дәҢзғҜзғғгҖҒзӮ”зғғВ В В В В В В C. зғ·зғғгҖҒзҺҜзғ·зғғВ В В В В В В В В В В В В В В D. зғҜзғғгҖҒзҺҜзғҜзғғ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ | |||
|
дёӢеҲ—жңүжңәзү©е‘ҪеҗҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
В BпјҺ CH3CH2CH2CH2OHВ В 1пјҚдёҒйҶҮ
CпјҺВ В В В В В В В В В В В В В В В В В В й—ҙдәҢз”ІиӢҜ В В В В В
DпјҺВ В В В В В В В В В В В В В 2вҖ”з”ІеҹәвҖ”2вҖ”дёҷзғҜ
|
||||
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҷ¶дҪ“дёӯдёҚеұһдәҺеҺҹеӯҗжҷ¶дҪ“зҡ„жҳҜпјҲВ В В пјү В В AпјҺе№ІеҶ° В В В В В В В В BпјҺйҮ‘еҲҡз ӮВ В В В В В В В В CпјҺйҮ‘еҲҡзҹіВ В В В В В В DпјҺж°ҙжҷ¶
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁжҒ’жё©жҒ’е®№жқЎд»¶дёӢпјҢиғҪдҪҝAпјҲgпјү+BпјҲgпјү A.еҮҸе°ҸCжҲ–Dзҡ„жө“еәҰВ В В В В В В В В В В В В В В В В В В B.еўһеӨ§Dзҡ„жө“еәҰ C.еҮҸе°ҸBзҡ„жө“еәҰВ В В В В В В В В В В В В В В В В В В В В В В В D.е……ж°Ұж°”
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗзғғзҡ„еҢ–еӯҰејҸдёә A. 1пјҢ3вҖ”дёҒдәҢзғҜВ В В В В В В В B. 1вҖ”дёҒзӮ”В В В В В В C. 2вҖ”дёҒзӮ”В В В В В В В В В В В В В D. з”ІеҹәдёҷзғҜ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—ж··еҗҲж°”дҪ“жҜ”д№ҷзғҜеҗ«зўізҷҫеҲҶзҺҮй«ҳзҡ„жҳҜпјҲВ В В пјүгҖӮ A. з”Ізғ·+дёҷзғҜВ В В В В В В В В В B. д№ҷзғ·+дёҒзғҜВ В C. д№ҷзӮ”+дёҷзғҜВ В В В В В В В В В D. д№ҷзғ·+дёҷзғҜ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗжңүжңәзү©зҡ„ж°ҙжә¶ж¶ІпјҢе®ғзҡ„ж°§еҢ–дә§зү©з”Іе’ҢиҝҳеҺҹдә§зү©д№ҷйғҪиғҪе’ҢйҮ‘еұһй’ еҸҚеә”ж”ҫеҮәH2гҖӮз”Іе’Ңд№ҷеҸҚеә”еҸҜз”ҹжҲҗдёҷпјҢз”Іе’ҢдёҷеқҮиғҪеҸ‘з”ҹ银й•ңеҸҚеә”гҖӮиҝҷз§Қжңүжңәзү©жҳҜпјҲВ В В пјү AпјҺз”ІйҶҮВ В В В В В В В пјўпјҺз”ІйҶӣВ В В В В В В CпјҺз”Ій…ёВ В В В В В В В DпјҺз”Ій…ёз”Ій…Ҝ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁеҗҢжё©еҗҢеҺӢдёӢпјҢжҹҗжңүжңәзү©е’ҢиҝҮйҮҸNaеҸҚеә”еҫ—еҲ°V1 Lж°ўж°”пјҢеҸҰдёҖд»ҪзӯүйҮҸзҡ„жңүжңәзү©е’Ңи¶і йҮҸзҡ„NaHCO3еҸҚеә”еҫ—V2 LдәҢж°§еҢ–зўіпјҢиӢҘV1=V2вү 0пјҢеҲҷжңүжңәзү©еҸҜиғҪжҳҜпјҲВ В В пјү
В В В В В В В В В В В В В В BпјҺHOOC-COOHВ В CпјҺHOCH2CH2OH В В DпјҺCH3COOH
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗй…Ҝзҡ„еҲҶеӯҗејҸжҳҜCn+3H2n+4O2пјҢе®ғжҳҜеҲҶеӯҗејҸдёәCnH2n-2O2зҡ„AдёҺжңүжңәзү©BеҸҚеә”з”ҹжҲҗзү© Bзҡ„еҲҶеӯҗејҸжҳҜВ В В В пјҲВ В В пјү В В AпјҺC3H6OВ В В В В В В В В В BпјҺC3H6O2 В В В В В В В В CпјҺC3H8OВ В В В В В В В В DпјҺC2H6O
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
еңЁдёҖе®ҡжқЎд»¶дёӢпјҢз”ІиӢҜеҸҜз”ҹжҲҗдәҢз”ІиӢҜж··еҗҲзү©е’ҢиӢҜгҖӮжңүе…ізү©иҙЁзҡ„жІёзӮ№гҖҒзҶ”зӮ№еҰӮдёӢпјҡ
дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) AпјҺиҜҘеҸҚеә”еұһдәҺеҸ–д»ЈеҸҚеә” BпјҺз”ІиӢҜзҡ„жІёзӮ№й«ҳдәҺ144 в„ғ CпјҺз”Ёи’ёйҰҸзҡ„ж–№жі•еҸҜе°ҶиӢҜд»ҺеҸҚеә”жүҖеҫ—дә§зү©дёӯйҰ–е…ҲеҲҶзҰ»еҮәжқҘ DпјҺд»ҺдәҢз”ІиӢҜж··еҗҲзү©дёӯпјҢз”ЁеҶ·еҚҙз»“жҷ¶зҡ„ж–№жі•еҸҜе°ҶеҜ№дәҢз”ІиӢҜеҲҶзҰ»еҮәжқҘ
|
||||||||||||||||
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
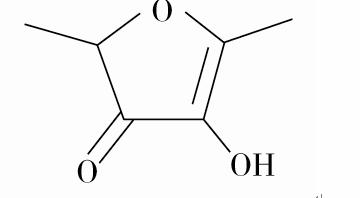
В е‘Ӣе–ғй…®пјҢеҸҲз§°иҸ иҗқй…®гҖҒиҚүиҺ“й…®пјҢе…·жңүејәзғҲзҡ„з„ҷзғӨз„Ұзі–йҰҷе‘іпјҢе№ҝжіӣеӯҳеңЁдәҺиҸ иҗқгҖҒиҚүиҺ“зӯүж°ҙжһңдёӯгҖӮдёӢеҲ—иҜҙжі•зЎ®зҡ„жҳҜ(гҖҖгҖҖ)
AпјҺе‘Ӣе–ғй…®зҡ„еҲҶеӯҗејҸдёәC6H9O3 BпјҺе‘Ӣе–ғй…®еҗ«жңүзҫҹеҹәгҖҒй…ҜеҹәдёӨз§Қеҗ«ж°§е®ҳиғҪеӣў CпјҺе‘Ӣе–ғй…®иғҪдҪҝжәҙзҡ„еӣӣж°ҜеҢ–зўіжә¶ж¶ІиӨӘиүІ DпјҺ1 molе‘Ӣе–ғй…®дёҺи¶ійҮҸйҮ‘еұһй’ еҸҚеә”з”ҹжҲҗ11.2 L H2
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүдёүз§ҚдёҚеҗҢеҸ–д»Јеҹә вҖ“XгҖҒ-YгҖҒ-ZпјҢеҪ“е®ғ们еҗҢж—¶дәҶеҸ–д»ЈиӢҜеҲҶеӯҗзҡ„3дёӘж°ўеҺҹеӯҗ,дё”жҜҸз§ҚеҸ–д»Јдә§зү©дёӯ,еҸӘжңүдёӨдёӘеҸ–д»ЈеҹәзӣёйӮ»ж—¶,еҸ–д»Јдә§зү©жңүВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ В пјү пјҲAпјү2з§ҚВ В В В В В В В пјҲBпјү4з§ҚВ В В В В В В В пјҲCпјү6з§ҚВ В В В В В В В пјҲDпјү10з§Қ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
В Cпј”Hпј‘пјҗOзҡ„жңүжңәзү©иғҪдёҺй’ дә§з”ҹж°ўж°”пјҢиҜҘжңүжңәзү©дёҺд№ҷдәҢй…ёеҸҚеә”з”ҹжҲҗзҡ„дәҢй…ҜжңүеҮ з§Қз»“жһ„ пјҲгҖҖгҖҖпјү гҖҖAпјҺ16гҖҖгҖҖгҖҖгҖҖпјўпјҺ10гҖҖгҖҖгҖҖгҖҖпјЈгҖҖпјҺ12гҖҖгҖҖгҖҖгҖҖпјӨпјҺ8гҖҖгҖҖгҖҖгҖҖ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҺдёҖз§Қж–°еһӢзҮғж–ҷз”өжұ пјҢд»Ҙй•Қжқҝдёәз”өжһҒжҸ’е…ҘKOHжә¶ж¶ІдёӯпјҢеҲҶеҲ«еҗ‘дёӨжһҒйҖҡд№ҷзғ·е’Ңж°§ж°”пјҢз”өжһҒеҸҚеә”дёәпјҡ AпјҺйҖҡж°§ж°”зҡ„з”өжһҒдёәжӯЈжһҒВ В В В В В В В В В В В В В В В В В BпјҺеҸӮеҠ еҸҚеә”зҡ„ CпјҺж”ҫз”өдёҖж®өж—¶й—ҙеҗҺпјҢKOHзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰе°ҶдёӢйҷҚВ В В В В В В DпјҺеңЁз”өи§ЈиҙЁжә¶ж¶Ідёӯ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүжңәе®һйӘҢдёӯдёҚйңҖиҰҒз”Ёжё©еәҰи®Ўзҡ„жҳҜВ (В В В В ) A.еҲ¶д№ҷзғҜВ В В В B .еҲ¶зЎқеҹәиӢҜВ В В В C .зҹіжІ№еҲҶйҰҸВ В В В D .еҲ¶жәҙиӢҜ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
дё»й“ҫдёҠжңү4дёӘзўіеҺҹеӯҗзҡ„жҹҗз§Қзғ·зғғпјҢжңүдёӨз§ҚеҗҢеҲҶејӮжһ„дҪ“пјҢеҗ«жңүзӣёеҗҢзўіеҺҹеӯҗж•°дё”дё»й“ҫд№ҹжңү4дёӘзўіеҺҹеӯҗзҡ„еҚ•зғҜзғғзҡ„еҗҢеҲҶејӮжһ„дҪ“жңүпјҲВ В В пјүВ В AпјҺ5з§ҚВ В В В В В В В BпјҺ4з§ҚВ В В В В В В В В CпјҺ3з§ҚВ В В В В В В В DпјҺ2з§Қ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
е®һйӘҢе®Өз”Ё4 mol SO2дёҺ2 mol O2еңЁдёҖе®ҡжқЎд»¶дёӢиҝӣиЎҢдёӢеҲ—еҸҚеә”пјҡ2SO2(g)пјӢO2(g) AпјҺ40%В В В В В В В BпјҺ50%В В В В В В В CпјҺ80%В В В В В В В DпјҺ90%
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
йӮ»з”ІеҹәиӢҜз”Ій…ёжңүеӨҡз§ҚеҗҢеҲҶејӮжһ„дҪ“пјҢе…¶дёӯеұһдәҺй…Ҝзұ»зҡ„еҗ«жңүиӢҜзҺҜзҡ„еҗҢеҲҶејӮжһ„дҪ“жңүпјҡ В В В пјҲВ В В В пјү В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В AпјҺ6з§ҚВ В В В В В В BпјҺ2з§ҚВ В В В В В В В CпјҺ4з§ҚВ В В В В В В В DпјҺ5з§Қ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ұд№ҷйҶҮеҲ¶еҸ–д№ҷдәҢй…ёд№ҷдәҢй…ҜпјҢжңҖз®ҖеҚ•зҡ„жөҒзЁӢйҖ”еҫ„йЎәеәҸжӯЈзЎ®зҡ„жҳҜВ В В В В пјҲВ В В пјү В В В в‘ еҸ–д»ЈеҸҚеә”пјӣгҖҖВ В В в‘ЎеҠ жҲҗеҸҚеә”пјӣгҖҖВ В В в‘ўж°§еҢ–еҸҚеә”пјӣВ В В В В в‘ЈиҝҳеҺҹеҸҚеә”пјӣгҖҖ В В В в‘Өж¶ҲеҺ»еҸҚеә”пјӣгҖҖВ В В в‘Ҙй…ҜеҢ–еҸҚеә”пјӣгҖҖВ В В в‘Ұдёӯе’ҢеҸҚеә”гҖӮ В В В AпјҺв‘Өв‘Ўв‘ в‘ўв‘ҘгҖҖгҖҖгҖҖгҖҖгҖҖВ В В В В В В В В В В В BпјҺв‘ в‘Ўв‘ўв‘Өв‘Ұ В В В CпјҺв‘Өв‘Ўв‘ в‘ўв‘ҰгҖҖгҖҖгҖҖВ В В В В В В В В В В В В В В В DпјҺв‘ в‘Ўв‘Өв‘ўв‘Ҙ
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—йҷӨеҺ»жқӮиҙЁзҡ„ж–№жі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү в‘ йҷӨеҺ»д№ҷзғ·дёӯе°‘йҮҸзҡ„д№ҷзғҜпјҡе…үз…§жқЎд»¶дёӢйҖҡе…ҘCl2пјҢж°”ж¶ІеҲҶзҰ»пјӣ в‘Ў еҲҶзҰ»жә¶дәҺж°ҙзҡ„зўҳпјҡд№ҷйҶҮиҗғеҸ–пјӣ в‘ў йҷӨеҺ»CO2дёӯе°‘йҮҸзҡ„SO2пјҡж°”дҪ“йҖҡиҝҮзӣӣйҘұе’Ңзўій…ёж°ўй’ жә¶ж¶Ізҡ„жҙ—气瓶пјӣ в‘Ј йҷӨеҺ»д№ҷйҶҮдёӯе°‘йҮҸзҡ„д№ҷй…ёпјҡеҠ и¶ійҮҸз”ҹзҹізҒ°пјҢи’ёйҰҸгҖӮ В В В AпјҺв‘ в‘ЎВ В В В В В В В BпјҺв‘Ў в‘ЈВ В В В В В В В В CпјҺв‘ў в‘ЈВ В В В В В В В В DпјҺв‘Ў в‘ў
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ | |||
|
еңЁдёҖе®ҡжё©еәҰдёӢзҡ„е®ҡе®№еҜҶй—ӯе®№еҷЁдёӯпјҢеҪ“дёӢеҲ—зү©зҗҶйҮҸдёҚеҶҚеҸҳеҢ–ж—¶пјҢиЎЁжҳҺеҸҚеә”пјҡAпјҲsпјү+ 2BпјҲgпјүВ В В В CпјҲgпјү+ DпјҲgпјүе·Іиҫҫе№іиЎЎзҡ„жҳҜпјҲВ В В пјү AпјҺж··еҗҲж°”дҪ“зҡ„еҺӢејәВ В В В В В В В В B. ж··еҗҲж°”дҪ“зҡ„еҜҶеәҰ CпјҺAзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰВ В В В В В В D. ж°”дҪ“зҡ„жҖ»зү©иҙЁзҡ„йҮҸ
|
||||
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
з»„жҲҗе’Ңз»“жһ„еҸҜз”Ё В В AпјҺ9з§ҚВ В В В В В В В В В В В В В В В BпјҺ12з§ҚВ В В В В В В В В В В CпјҺ24з§ҚВ В В В В В В DпјҺ36з§Қ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
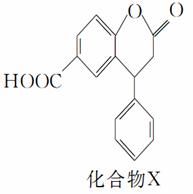
еҢ–еҗҲзү©XжҳҜдёҖз§ҚеҢ»иҚҜдёӯй—ҙдҪ“пјҢе…¶з»“жһ„з®ҖејҸеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—жңүе…іеҢ–еҗҲзү©Xзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
AпјҺеҲҶеӯҗдёӯдёӨдёӘиӢҜзҺҜдёҖе®ҡеӨ„дәҺеҗҢдёҖе№ійқў BпјҺдёҚиғҪдёҺйҘұе’ҢNa2CO3жә¶ж¶ІеҸҚеә” CпјҺеңЁй…ёжҖ§жқЎд»¶дёӢж°ҙи§ЈпјҢж°ҙи§Јдә§зү©еҸӘжңүдёҖз§Қ DпјҺ1 molеҢ–еҗҲзү©XжңҖеӨҡиғҪдёҺ7 mol ж°ўж°”еҸҚеә”
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁж°ҙдёӯеҠ е…Ҙзӯүзү©иҙЁзҡ„йҮҸзҡ„AgNO3гҖҒBaпјҲNO3пјү2гҖҒNaClгҖҒK2SO4ж··еҗҲеқҮеҢҖпјҢеҸ–жә¶ж¶ІпјҢз”Ёжғ°жҖ§з”өжһҒз”өи§ЈпјҢзүҮеҲ»еҗҺеңЁдёӨдёӘжһҒеҢәжһҗеҮәзҡ„ж°§еҢ–дә§зү©дёҺиҝҳеҺҹдә§зү©зҡ„зү©иҙЁзҡ„иҙЁйҮҸд№ӢжҜ”дёәпјҲВ В В пјү В В AпјҺ35.5пјҡ108В В В В В В В BпјҺlпјҡ2В В В В CпјҺ108пјҡ35.5В В В В В DпјҺ8пјҡ1
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ |
|
з”өи§Ј 100 me еҗ«c(HпјӢ)=0.30 molВ·LпјҚ1 зҡ„дёӢеҲ—жә¶ж¶ІпјҢеҪ“з”өи·ҜдёӯйҖҡиҝҮ0.04 mol з”өеӯҗж—¶пјҢзҗҶи®әдёҠжһҗеҮәйҮ‘еұһиҙЁйҮҸжңҖеӨ§зҡ„жҳҜпјҲВ В В пјү AпјҺ0.10molВ·LпјҚ1 AgпјӢВ BпјҺ0.20 molВ·LпјҚ1 Zn2пјӢ В В CпјҺ0.20 molВ·LпјҚ1 Cu2пјӢВ DпјҺ0.20 molВ·LпјҚ1 Pb2пјӢ
|
|
| 27. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺеҗ«жңүзҰ»еӯҗй”®зҡ„еҢ–еҗҲзү©иӮҜе®ҡжҳҜзҰ»еӯҗеҢ–еҗҲзү© BпјҺеҗ«жңүе…ұд»·й”®зҡ„еҢ–еҗҲзү©дёҖе®ҡжҳҜе…ұд»·еҢ–еҗҲзү© CпјҺзҰ»еӯҗй”®е’Ңе…ұд»·й”®дёҚиғҪеӯҳеңЁдәҺеҗҢз§ҚеҢ–еҗҲзү©дёӯ DпјҺеҢ–еӯҰй”®дёҚд»…еӯҳеңЁдәҺеҺҹеӯҗй—ҙд№ҹеӯҳеңЁдәҺеҲҶеӯҗй—ҙ
|
|
| 28. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҺиҮӘ然з•Ңдёӯзҡ„и®ёеӨҡеҸҳеҢ–дёҖж ·пјҢеҢ–еӯҰеҸҚеә”е…·жңүж–№еҗ‘жҖ§гҖӮдёӢеҲ—жңүе…іеҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A. еҺҹз”өжұ еҸҚеә”дёҖе®ҡжҳҜиҮӘеҸ‘иҝӣиЎҢзҡ„ж°§еҢ–иҝҳеҺҹеҸҚеә”пјҢдё”в–іHпјң0 B.В О”H<0пјҢО”S<0зҡ„еҸҚеә”иӮҜе®ҡиғҪиҮӘеҸ‘иҝӣиЎҢ C. дҪ“зі»иғҪйҮҸеўһеӨ§е’Ңж··д№ұеәҰеўһеӨ§йғҪжңүдҝғдҪҝеҸҚеә”иҮӘеҸ‘иҝӣиЎҢзҡ„еҖҫеҗ‘ D. CaCO3(s) пјқCaO(s)+CO2(g)зҡ„О”Hпјһ0пјҢО”Sпјң0пјҢиҜҘеҸҚеә”еңЁиҫғй«ҳжё©еәҰдёӢиғҪиҮӘеҸ‘иҝӣиЎҢ
|
|
| 29. | иҜҰз»ҶдҝЎжҒҜ |
|
е®һйӘҢжөӢеҫ—пјҡ101 kPaж—¶пјҢ1 mol H2е®Ңе…ЁзҮғзғ§з”ҹжҲҗж¶ІжҖҒж°ҙпјҢж”ҫеҮә285.8 kJзҡ„зғӯйҮҸпјӣ1 mol CH4е®Ңе…ЁзҮғзғ§з”ҹжҲҗж¶ІжҖҒж°ҙе’ҢCO2пјҢж”ҫеҮә890.3 kJзҡ„зғӯйҮҸгҖӮдёӢеҲ—зғӯеҢ–еӯҰж–№зЁӢејҸзҡ„д№ҰеҶҷжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү в‘ CH4(g)пјӢ2O2(g)===CO2(g)пјӢ2H2O(l)В В О”HпјқпјӢ890.3 kJВ·molпјҚ1 в‘ЎCH4(g)пјӢ2O2(g)===CO2(g)пјӢ2H2O(l)В В О”HпјқпјҚ890.3 kJВ·molпјҚ1 в‘ўCH4(g)пјӢ2O2(g)===CO2(g)пјӢ2H2O(g)В В О”HпјқпјҚ890.3 kJВ·molпјҚ1 в‘Ј2H2(g)пјӢO2(g)===2H2O(l)В В О”HпјқпјҚ571.6 kJВ·molпјҚ1 AпјҺд»…жңүв‘ЎгҖҖВ В В В В В В В В В В В BпјҺд»…жңүв‘Ўв‘Ј CпјҺд»…жңүв‘Ўв‘ўв‘ЈВ В В В В В В В В В DпјҺе…ЁйғЁз¬ҰеҗҲиҰҒжұӮ
|
|
| 30. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іе…ғзҙ зҡ„жҖ§иҙЁеҸҠе…¶йҖ’еҸҳ规еҫӢжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјүВ В В В В В В В В В В В В A.в… Aж—ҸдёҺв…ҰAж—Ҹе…ғзҙ й—ҙеҸҜеҪўжҲҗе…ұд»·еҢ–еҗҲзү©жҲ–зҰ»еӯҗеҢ–еҗҲзү© B.第дәҢе‘Ёжңҹе…ғзҙ д»Һе·ҰеҲ°еҸіпјҢжңҖй«ҳжӯЈд»·д»ҺпјӢ1йҖ’еўһеҲ°пјӢ7 C.еҗҢдё»ж—Ҹе…ғзҙ зҡ„з®ҖеҚ•йҳҙзҰ»еӯҗиҝҳеҺҹжҖ§и¶ҠејәпјҢеҚҠеҫ„и¶Ҡе°Ҹ D.еҗҢе‘ЁжңҹйҮ‘еұһе…ғзҙ зҡ„еҢ–еҗҲд»·и¶Ҡй«ҳпјҢе…¶еҺҹеӯҗеӨұз”өеӯҗиғҪеҠӣи¶Ҡејә
|
|
| 31. | иҜҰз»ҶдҝЎжҒҜ |
|
еҸҜйҖҶеҸҚеә”пјҡ2SO2(g)пјӢO2(g) в‘ еҚ•дҪҚж—¶й—ҙеҶ…ж¶ҲиҖ—n mol SO2зҡ„еҗҢж—¶з”ҹжҲҗn mol SO2 в‘ЎеҚ•дҪҚж—¶й—ҙеҶ…ж¶ҲиҖ—2n mol SO2зҡ„еҗҢж—¶з”ҹжҲҗn mol O2 в‘ўз”ЁSO2гҖҒO2гҖҒSO3зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰеҸҳеҢ–иЎЁзӨәзҡ„еҸҚеә”йҖҹзҺҮзҡ„жҜ”дёә2вҲ¶1вҲ¶2зҡ„зҠ¶жҖҒ в‘Јж··еҗҲж°”дҪ“зҡ„еҜҶеәҰдёҚеҶҚж”№еҸҳзҡ„зҠ¶жҖҒ AпјҺв‘ в‘ЎВ В В В В В В В В В В В В В В В В В В В В В В В В В В В BпјҺв‘ в‘Ўв‘ЈВ В В В В В В В В В В В В CпјҺв‘ в‘Ўв‘ўВ В В В В В В В В В В В В В В В В В В В В В В В В В DпјҺв‘ в‘ўв‘Ј
|
|
| 32. | иҜҰз»ҶдҝЎжҒҜ |
|
еҸіеӣҫдёәзӣҙжөҒз”өжәҗз”өи§ЈзЁҖNa2SO4ж°ҙжә¶ж¶Ізҡ„иЈ…зҪ®гҖӮйҖҡз”өеҗҺеңЁзҹіеўЁз”өжһҒaе’Ңbйҷ„иҝ‘еҲҶеҲ«ж»ҙеҠ еҮ ж»ҙзҹіи•Ҡжә¶ж¶ІгҖӮдёӢеҲ—е®һйӘҢзҺ°иұЎдёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
BпјҺдёҖз”өжһҒйҖёеҮәж— е‘іж°”дҪ“пјҢеҸҰдёҖз”өжһҒйҖёеҮәеҲәжҝҖжҖ§ж°”е‘іж°” CпјҺaз”өжһҒйҷ„иҝ‘е‘ҲзәўиүІпјҢbз”өжһҒйҷ„иҝ‘е‘Ҳи“қиүІ DпјҺaз”өжһҒйҷ„иҝ‘е‘Ҳи“қиүІпјҢbз”өжһҒйҷ„иҝ‘е‘ҲзәўиүІ
|
|
| 33. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү AпјҺеңЁеҺҹз”өжұ зҡ„иҙҹжһҒе’Ңз”өи§Јжұ зҡ„йҳҙжһҒдёҠйғҪжҳҜеҸ‘з”ҹеӨұз”өеӯҗзҡ„ж°§еҢ–еҸҚеә” BпјҺз”Ёжғ°жҖ§з”өжһҒз”өи§Јж°ҜеҢ–й“ңжә¶ж¶ІпјҢйҳҙйҳідёӨжһҒдә§зү©зҡ„зү©иҙЁзҡ„йҮҸжҜ”дёә1пјҡ2 CпјҺз”Ёжғ°жҖ§з”өжһҒз”өи§ЈйҘұе’ҢNaClжә¶ж¶ІпјҢиӢҘжңү1 molз”өеӯҗиҪ¬з§»пјҢеҲҷз”ҹжҲҗ1 molNaOH DпјҺй•ҖеұӮз ҙжҚҹеҗҺпјҢй•Җй”Ўй“ҒжқҝжҜ”й•Җй”Ңй“ҒжқҝжӣҙиҖҗи…җиҡҖ
|
|
| 34. | иҜҰз»ҶдҝЎжҒҜ |
|
е®һйӘҢе®Өз”Ёй“…и“„з”өжұ дҪңз”өжәҗз”өи§ЈйҘұе’ҢйЈҹзӣҗж°ҙеҲ¶еҸ–ж°Ҝж°”пјҢе·ІзҹҘй“…и“„з”өжұ ж”ҫз”өж—¶еҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡиҙҹжһҒPb+SO В В В AпјҺ0.025 molВ В В В В В В В В BпјҺ0.050 molВ В В В В CпјҺ0.10 molВ В В В В В В В В В DпјҺ0.20 mol
|
|
| 35. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
йҷӨеҺ»дёӢеҲ—зү©иҙЁдёӯжүҖеҗ«е°‘йҮҸжқӮиҙЁ(жӢ¬еҸ·еҶ…дёәжқӮиҙЁ)пјҢжүҖйҖүз”Ёзҡ„иҜ•еүӮе’ҢеҲҶзҰ»ж–№жі•иғҪиҫҫеҲ°е®һйӘҢзӣ®зҡ„жҳҜпјҲВ В В пјүВ
|
|||||||||||||||||||||
| 36. | иҜҰз»ҶдҝЎжҒҜ |
|
пјҲ1пјүзҺ°жңүз”Ізғ·пјҢ д№ҷйҶҮпјҢ д№ҷй…ёпјҢ дёҷзӮ”еӣӣз§Қжңүжңәзү©пјҢзӯүзү©иҙЁзҡ„йҮҸж—¶пјҢе®Ңе…ЁзҮғзғ§ж¶ҲиҖ—ж°§ж°”жңҖеӨҡзҡ„________ пјӣзӯүиҙЁйҮҸж—¶пјҢе®Ңе…ЁзҮғзғ§ж¶ҲиҖ—ж°§ж°”жңҖеӨҡзҡ„________ пјӣзӯүиҙЁйҮҸж—¶пјҢе®Ңе…ЁзҮғзғ§з”ҹжҲҗж°ҙжңҖеӨҡзҡ„________ пјӣзӯүзү©иҙЁзҡ„йҮҸж—¶пјҢе®Ңе…ЁзҮғзғ§з”ҹжҲҗж°ҙжңҖеӨҡзҡ„ ________ гҖӮ (2) иғҪдёҺжәҙж°ҙеҠ жҲҗдё”еӣӣдёӘжәҙеҺҹеӯҗеҲҶеёғеңЁеӣӣдёӘзўіеҺҹеӯҗдёҠзҡ„иҜҘзғғзҡ„з»“жһ„з®ҖејҸдёә В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲ3пјүеҲҶеӯҗејҸдёәC5H12Oзҡ„йҶҮе…ұ________з§Қз»“жһ„пјҢе…¶дёӯдёҚиғҪеҸ‘з”ҹеӮ¬еҢ–ж°§еҢ–еҸҚеә”зҡ„з»“жһ„з®ҖејҸдёә________пјӣдёҚиғҪеҸ‘з”ҹж¶ҲеҺ»еҸҚеә”зҡ„з»“жһ„з®ҖејҸдёә_______________
|
|
| 37. | иҜҰз»ҶдҝЎжҒҜ |
|
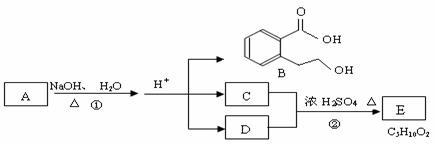
дёӢеӣҫдёӯ AгҖҒBгҖҒCгҖҒDгҖҒEеқҮдёәжңүжңәеҢ–еҗҲзү©гҖӮе·ІзҹҘпјҡCиғҪи·ҹNaHCO3еҸ‘з”ҹеҸҚеә”пјҢпјЈе’ҢпјӨзҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸзӣёзӯүпјҢдё”Eдёәж— ж”Ҝй“ҫзҡ„еҢ–еҗҲзү©гҖӮ
В В В ж №жҚ®дёҠеӣҫеӣһзӯ”й—®йўҳпјҡ В В пјҲ1пјүCеҲҶеӯҗдёӯзҡ„е®ҳиғҪеӣўеҗҚз§°жҳҜ ______________пјӣ еҢ–еҗҲзү©BдёҚиғҪеҸ‘з”ҹзҡ„еҸҚеә”жҳҜВ В В В В ______________пјӣпјҲеЎ«еӯ—жҜҚеәҸеҸ·пјүпјҡ a еҠ жҲҗеҸҚеә”В bеҸ–д»ЈеҸҚеә”В cж¶ҲеҺ»еҸҚеә” dй…ҜеҢ–еҸҚеә”В eж°ҙи§ЈеҸҚеә”В f зҪ®жҚўеҸҚеә” В В пјҲ2пјүеҸҚеә”в‘Ўзҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜ_________________В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲ3пјүиҜ•еҲҶжһҗеҸҚеә”в‘Ўжө“зЎ«й…ёзҡ„дҪңз”Ё____________________________пјӣ В В пјҲ4пјүAзҡ„з»“жһ„з®ҖејҸжҳҜ __________________В В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 38. | иҜҰз»ҶдҝЎжҒҜ |
|
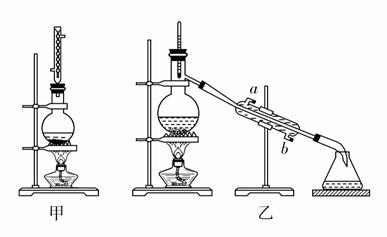
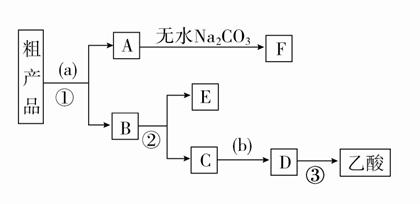
е®һйӘҢе®ӨеҗҲжҲҗд№ҷй…ёд№ҷй…Ҝзҡ„жӯҘйӘӨеҰӮдёӢпјҡеңЁеңҶеә•зғ§з“¶еҶ…еҠ е…Ҙд№ҷйҶҮгҖҒжө“зЎ«й…ёе’Ңд№ҷй…ёпјҢ瓶еҸЈз«–зӣҙе®үиЈ…йҖҡжңүеҶ·еҚҙж°ҙзҡ„еҶ·еҮқз®Ў(дҪҝеҸҚеә”ж··еҗҲзү©зҡ„и’ёжұҪеҶ·еҮқдёәж¶ІдҪ“еҗҺжөҒеӣһзғ§з“¶еҶ…)(еҰӮеӣҫз”І)пјҢеҠ зғӯеӣһжөҒдёҖж®өж—¶й—ҙеҗҺжҚўжҲҗи’ёйҰҸиЈ…зҪ®(еҰӮеӣҫд№ҷ)иҝӣиЎҢи’ёйҰҸпјҢеҫ—еҲ°еҗ«жңүд№ҷйҶҮгҖҒд№ҷй…ёе’Ңж°ҙзҡ„д№ҷй…ёд№ҷй…ҜзІ—дә§е“ҒпјҢиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
(1)еңЁеӣҫз”Ізғ§з“¶дёӯйҷӨдәҶеҠ е…Ҙд№ҷй…ёгҖҒжө“зЎ«й…ёе’Ңд№ҷйҶҮеӨ–пјҢиҝҳеә”ж”ҫе…Ҙ________пјҢзӣ®зҡ„жҳҜ_____________________гҖӮгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖ (2)еӣҫд№ҷдёӯеҶ·еҮқж°ҙд»Һ________еҸЈиҝӣпјҢ________еҸЈеҮәгҖӮ (3)зҺ°жӢҹеҲҶзҰ»еҗ«д№ҷй…ёгҖҒд№ҷйҶҮе’Ңж°ҙзҡ„д№ҷй…ёд№ҷй…ҜзІ—дә§е“ҒпјҢеҰӮеӣҫжҳҜеҲҶзҰ»ж“ҚдҪңжӯҘйӘӨжөҒзЁӢеӣҫпјҢиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳгҖӮ
иҜ•еүӮaжҳҜ________пјҢиҜ•еүӮbжҳҜ__________пјӣж— ж°ҙзўій…ёй’ зҡ„дҪңз”Ё________пјҢеҲҶзҰ»ж–№жі•в‘ жҳҜ________пјҢеҲҶзҰ»ж–№жі•в‘ЎжҳҜ________пјҢеҲҶзҰ»ж–№жі•в‘ўжҳҜ________гҖӮ (4)жҹҗеҢ–еӯҰиҜҫеӨ–е°Ҹз»„и®ҫи®ЎдәҶеҰӮеӣҫжүҖзӨәзҡ„еҲ¶еҸ–д№ҷй…ёд№ҷй…Ҝзҡ„иЈ…зҪ®(еӣҫдёӯзҡ„й“Ғжһ¶еҸ°гҖҒй“ҒеӨ№гҖҒеҠ зғӯиЈ…зҪ®е·Із•ҘеҺ»)пјҢдёҺдёҠеӣҫиЈ…зҪ®зӣёжҜ”пјҢжӯӨиЈ…зҪ®зҡ„дё»иҰҒдјҳзӮ№жҳҜ_____________________гҖӮ
|
|
- жұҹиҘҝзңҒдёҙе·қдёҖдёӯ2020еұҠдёҠеҶҢ第дәҢж¬ЎиҒ”еҗҲиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·
- еӨ§иҝһеёӮй«ҳдёүеҢ–еӯҰ2019е№ҙеүҚеҚҠжңҹжңҲиҖғжөӢйӘҢеңЁзәҝе…Қиҙ№иҖғиҜ•
- е®ҒеӨҸ银е·қдёҖдёӯ2020еұҠй«ҳдёүдёҠеҚҠе№ҙ第дёҖж¬ЎжңҲиҖғзҗҶз»јеҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- жұҹиӢҸжү¬е·һеёӮ2021еұҠй«ҳдёүдёҠжңҹжңҹдёӯи°ғз ”еҢ–еӯҰйўҳе…Қиҙ№еңЁзәҝжЈҖжөӢ
- еӣӣе·қзңҒеҢ—еӨ§жҲҗйғҪйҷ„еұһе®һйӘҢдёӯеӯҰ2021еұҠй«ҳдёүдёҠеҚҠжңҹејҖеӯҰиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- й«ҳдёҖеҢ–еӯҰдёҠеҶҢеҚ•е…ғжөӢиҜ•иҜ•еҚ·е®Ңж•ҙзүҲ
- жұҹиӢҸй«ҳдәҢеҢ–еӯҰ2019е№ҙдёҠеҚҠжңҹжңҲиҖғжөӢйӘҢзҪ‘з»ңиҖғиҜ•иҜ•еҚ·
- йҳңйҳідёүдёӯй«ҳдәҢеҢ–еӯҰй«ҳиҖғжЁЎжӢҹпјҲ2019е№ҙеүҚеҚҠжңҹпјүеңЁзәҝе…Қиҙ№иҖғиҜ•