2019жөҷжұҹй«ҳдёҖдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
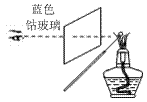
еҢ–еӯҰдёҺдәәзұ»з”ҹдә§гҖҒз”ҹжҙ»еҜҶеҲҮзӣёе…ігҖӮдёӢеҲ—жңүе…іиҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ
BпјҺеӨ©з„¶ж°”иҝҗиҫ“ж—¶еә”жӮ¬жҢӮеҸіеӣҫжүҖзӨәзҡ„ж Үеҝ— CпјҺйқўзІүз”ҹдә§иҪҰй—ҙеә”дёҘзҰҒзғҹзҒ« DпјҺйҮ‘еұһй’ зқҖзҒ«ж—¶дҪҝз”ЁжіЎжІ«зҒӯзҒ«еҷЁжҲ–ж°ҙзҒӯзҒ«
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іеҢ–еӯҰз”ЁиҜӯиЎЁзӨәдёӯжӯЈзЎ®зҡ„жҳҜ AпјҺдёӯеӯҗж•°дёә8зҡ„зўіеҺҹеӯҗпјҡ CпјҺж°ҹзҰ»еӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҳеҢ–еұһдәҺзү©зҗҶеҸҳеҢ–зҡ„жҳҜ AпјҺд»Һжө·еёҰдёӯжҸҗеҸ–еҚ•иҙЁзўҳВ В В В В В В В В В В В В BпјҺжҙ»жҖ§зӮӯеҗёйҷ„ејӮе‘і CпјҺе°Ҷй»Ҹеңҹзғ§з»“жҲҗйҷ¶з“·В В В В В В В В В В В В В В В DпјҺжјӮзҷҪзІүжјӮзҷҪз»Үзү©
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁеұһдәҺзәҜеҮҖзү©зҡ„жҳҜ AпјҺж¶Іж°ҜВ В В В В В В В В В В BпјҺеҗҲйҮ‘В В В В В В В В CпјҺж°ҙзҺ»з’ғВ В В В В DпјҺжјӮзҷҪзІү
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
йҷӨеҺ»CO2дёӯзҡ„HClж°”дҪ“пјҢжүҖйҖүз”Ёзҡ„иҜ•еүӮеҗҲзҗҶзҡ„жҳҜ AпјҺNaOHжә¶ж¶ІВ В В В В В В В В В В В В В В В В В В В В В В В BпјҺж°Ёж°ҙ CпјҺйҘұе’ҢNaHCO3жә¶ж¶ІВ В В В В В В В В В В В В В В В В В DпјҺйҘұе’ҢNa2CO3жә¶ж¶І
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
еҪ“е…үжқҹйҖҡиҝҮдёӢеҲ—еҲҶж•Јзі»пјҡв‘ зғҹйӣҫ в‘ЎзЁҖзЎ«й…ё в‘ўи’ёйҰҸж°ҙ в‘ЈйёЎиӣӢжё…жә¶ж¶ІпјҢиғҪи§ӮеҜҹеҲ°жңүдёҒиҫҫе°”зҺ°иұЎзҡ„жҳҜпјҲгҖҖ пјү AпјҺв‘ в‘ЎВ В В В В В В В В В BпјҺв‘Ўв‘ўВ В В В В В В В В В CпјҺв‘ в‘ЈВ В В В В В В В В В DпјҺв‘Ўв‘Ј
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
зІ—з•ҘжөӢе®ҡиҚүжңЁзҒ°дёӯзўій…ёй’ҫзҡ„еҗ«йҮҸ并жЈҖйӘҢй’ҫе…ғзҙ зҡ„еӯҳеңЁпјҢйңҖз»ҸиҝҮз§°йҮҸгҖҒжә¶и§ЈгҖҒиҝҮж»ӨгҖҒи’ёеҸ‘гҖҒз„°иүІеҸҚеә”зӯүж“ҚдҪңгҖӮдёӢеҲ—еӣҫзӨәеҜ№еә”зҡ„ж“ҚдҪңдёҚ规иҢғзҡ„жҳҜ
AпјҺз§°йҮҸВ В В В В В В В В В В BпјҺжә¶и§ЈВ В В В В В В В В В CпјҺи’ёеҸ‘В В В В В В В В DпјҺз„°иүІеҸҚеә”
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зҰ»еӯҗиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ AпјҺFe3+гҖҒCu2пјӢгҖҒClпјҚгҖҒNO CпјҺCa2+гҖҒFe2пјӢгҖҒSO
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҳеҢ–иҝҮзЁӢдёӯпјҢеҠ е…Ҙж°§еҢ–еүӮжүҚиғҪе®һзҺ°зҡ„жҳҜ AпјҺCl2вҶ’ClЛү В В В В В В BпјҺIЛүвҶ’I2В CпјҺSO2вҶ’SO
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ҘдёҡеҲ¶еҸ–й«ҳзәҜзЎ…зҡ„еҸҚеә”жөҒзЁӢеҰӮдёӢпјҢе…¶дёӯжңүдёӨдёӘеҸҚеә”зұ»еһӢзӣёеҗҢпјҢиҝҷдёӨдёӘеҸҚеә”зҡ„зұ»еһӢжҳҜ
AпјҺзҪ®жҚўеҸҚеә”В В В В BпјҺеӨҚеҲҶи§ЈеҸҚеә”В В В CпјҺеҲҶи§ЈеҸҚеә”В В В В DпјҺеҢ–еҗҲеҸҚеә”
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ AпјҺе®ҡе®№ж—¶пјҢеӣ дёҚж…ҺдҪҝж¶Ійқўй«ҳдәҺе®№йҮҸ瓶зҡ„еҲ»еәҰзәҝпјҢеҸҜз”Ёж»ҙз®Ўе°ҶеӨҡдҪҷж¶ІдҪ“еҗёеҮә BпјҺз„°иүІеҸҚеә”ж—¶пјҢе…Ҳз”ЁзЁҖзӣҗй…ёжҙ—ж¶Өй“Ӯдёқ并еңЁй…’зІҫзҒҜзҒ«з„°дёҠзҒјзғ§пјҢ然еҗҺеҶҚиҝӣиЎҢе®һйӘҢ CпјҺе°Ҷж–°еҲ¶ж°Ҝж°ҙж»ҙе…Ҙзҙ«иүІзҹіи•Ҡжә¶ж¶ІдёӯпјҢеҸҜд»ҘзңӢеҲ°зҹіи•Ҡжә¶ж¶Іе…ҲеҸҳзәўеҗҺиӨӘиүІ DпјҺеҸ–е°‘йҮҸжҷ¶дҪ“ж”ҫе…ҘиҜ•з®ЎдёӯпјҢеҶҚеҠ е…ҘйҖӮйҮҸNaOHжә¶ж¶ІпјҢеҠ зғӯпјҢеңЁиҜ•з®ЎеҸЈз”Ёж№ҝж¶Ұзҡ„зәўиүІзҹіи•ҠиҜ•зәёжЈҖйӘҢпјҢиӢҘиҜ•зәёеҸҳи“қпјҢеҲҷеҸҜиҜҒжҳҺиҜҘжҷ¶дҪ“дёӯеҗ«жңүNH
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
В дёӢеҲ—е®һйӘҢж“ҚдҪңгҖҒзҺ°иұЎе’Ңз»“и®әеқҮжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
|
|||||||||||||||||||||
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗзӣҗзҡ„ж··еҗҲзү©дёӯеҗ«жңү0.2 molпјҸL Na+гҖҒ0.4 molпјҸL Mg2+гҖҒ0.4 molпјҸL ClЛүпјҢеҲҷSO42ЛүдёәпјҲ В В В пјүгҖӮ AпјҺ0.1 molпјҸLВ В В В В В BпјҺ0.2 molпјҸLВ В В В CпјҺ0.3 molпјҸLВ В В В В В DпјҺ0.4 molпјҸLВ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„жӢ¬еҸ·еҶ…зҡ„иҜ•еүӮжҲ–ж–№жі•дёҚиғҪйҷӨеҺ»жқӮиҙЁзҡ„жҳҜ(гҖҖгҖҖ) AпјҺFeзІүдёӯж··жңүZnзІүжқӮиҙЁ(зЁҖH2SO4) В В В BпјҺFeCl3жә¶ж¶Ідёӯж··жңүFeCl2жқӮиҙЁ(Cl2) CпјҺNaClеӣәдҪ“дёӯж··жңүI2жқӮиҙЁ(еҠ зғӯ)В В В В В В В DпјҺSiO2дёӯж··жңүCaCO3жқӮиҙЁ(зӣҗй…ё)
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёӢеҲ—жҢҮе®ҡеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜ AпјҺзўій…ёй•Ғжә¶дәҺзӣҗй…ёпјҡCO3 2-пјӢ2HпјӢпјқH2OпјӢCO2вҶ‘ BпјҺж°ўж°§еҢ–й’Ўжә¶ж¶ІдёҺзЎ«й…ёй“ңжә¶ж¶ІеҸҚеә”пјҡBa2+пјӢSO CпјҺCuCl2 жә¶ж¶ІдёҺй“ҒзІүеҸҚеә”пјҡВ 3Cu2+пјӢ2Fe пјқ3CuпјӢ2Fe3+ DпјҺйҮ‘еұһй’ дёҺж°ҙеҸҚеә”пјҡВ 2NaпјӢ2H2O В пјқ2NaпјӢпјӢ2OHпјҚпјӢH2вҶ‘
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢз»“и®әжӯЈзЎ®зҡ„жҳҜ AпјҺз”ЁFeCl3жә¶ж¶Іи…җиҡҖеҚ°еҲ·з”өи·ҜжқҝдёҠзҡ„й“ңпјҢжүҖеҫ—зҡ„жә¶ж¶ІдёӯеҠ е…Ҙй“ҒзІүпјҢиӢҘеҠ е…Ҙй“ҒзІүе……еҲҶеҸҚеә”еҗҺзҡ„жә¶ж¶Іж— еӣәдҪ“еү©дҪҷпјҢеҲҷжә¶ж¶ІдёӯдёҖе®ҡжңүFe3+ BпјҺеҗ‘жҹҗжә¶ж¶ІдёӯеҠ е…Ҙж°ҜеҢ–й’Ўжә¶ж¶ІжңүзҷҪиүІжІүж·Җдә§з”ҹпјҢеҶҚеҠ е…Ҙзӣҗй…ёжІүж·ҖдёҚж¶ҲеӨұпјҢеҲҷиҜҘжә¶ж¶ІдёӯдёҖе®ҡжңү SO4 2- CпјҺеҗ‘жҹҗжә¶ж¶ІдёӯеҠ е…ҘзЁҖзӣҗй…ёдә§з”ҹж— иүІж— е‘іж°”дҪ“пјҢе°Ҷж°”дҪ“йҖҡе…Ҙжҫ„жё…зҹізҒ°ж°ҙдёӯпјҢзҹізҒ°ж°ҙеҸҳжө‘жөҠпјҢеҲҷеҺҹжә¶ж¶ІдёӯдёҖе®ҡжңү CO32- D.еҗ‘жҹҗжә¶ж¶ІдёӯеҠ е…Ҙ NaOH жө“жә¶ж¶ІпјҢеҠ зғӯпјҢдә§з”ҹзҡ„ж°”дҪ“иғҪдҪҝж№ҝж¶Ұзҡ„зәўиүІзҹіи•ҠиҜ•зәёеҸҳи“қпјҢеҲҷ иҜҘжә¶ж¶ІдёӯдёҖе®ҡжңү NH4 +
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
еӣӣз§Қзҹӯе‘Ёжңҹе…ғзҙ XгҖҒYгҖҒZе’ҢWеңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®еҰӮеӣҫжүҖзӨәпјҢеҺҹеӯҗеәҸж•°д№Ӣе’Ңдёә48гҖӮ
BпјҺXе’ҢWеҸҜеҪўжҲҗеҢ–еҗҲзү©XW3 CпјҺWзҡ„йқһйҮ‘еұһжҖ§жҜ”Zзҡ„ејәпјҢжүҖд»ҘWж°ўеҢ–зү©зҡ„жІёзӮ№жҜ”Zзҡ„й«ҳ DпјҺZзҡ„жңҖдҪҺд»·еҚ•ж ёйҳҙзҰ»еӯҗзҡ„еӨұз”өеӯҗиғҪеҠӣжҜ”Yзҡ„ејә
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ё NA иЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ11.2 L H2O В еҗ«жңүзҡ„ж°ўеҺҹеӯҗж•°жҳҜNA BпјҺ24 g Mg дёӯеҗ«жңүзҡ„з”өеӯҗж•°жҳҜ 2NA CпјҺ0.5 molВ·LпјҚ1K 2SO4жә¶ж¶Ідёӯеҗ«жңүзҡ„й’ҫзҰ»еӯҗж•°жҳҜNA D.еёёжё©еёёеҺӢдёӢпјҢ3.2 g ж°§ж°”жүҖеҗ«зҡ„еҲҶеӯҗж•°жҳҜ 0.1 NA
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
жө·жҙӢдёӯжңүдё°еҜҢзҡ„иө„жәҗпјҢдёӢеӣҫдёәжө·ж°ҙеҲ©з”Ёзҡ„йғЁеҲҶиҝҮзЁӢгҖӮдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜ
AпјҺз”ұеҸҚеә”в‘ еҸҜзҹҘпјҡзӣёеҗҢжё©еәҰдёӢпјҢNaHCO3зҡ„жә¶и§ЈеәҰеӨ§дәҺNa2CO3 BпјҺйҖҡиҝҮз”өи§ЈMgCl2В·6H2Oжҷ¶дҪ“еҸҜд»ҘиҺ·еҫ—MgеҚ•иҙЁ CпјҺеҸҚеә”в‘Ўзҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҡBr2пјӢSO2пјӢ2H2OпјқSO DпјҺзІ—зӣҗдёӯеҗ«жңүзҡ„Mg2пјӢгҖҒSO
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
й«ҳй“Ғй…ёзӣҗеҸҜз”ЁдҪңеҮҖж°ҙеүӮпјҢдёҚд»…еҸҜд»Ҙж¶ҲжҜ’жқҖиҸҢпјҢиҝҳиғҪеҗёйҷ„ж°ҙдёӯжӮ¬жө®зү©пјҢеҸҜд»Ҙз”ЁдёӢйқўеҸҚеә”еҲ¶еҫ—пјҡFe2O3пјӢ KOHпјӢ KClOвҖ”вҖ” K2FeO4пјӢ KClпјӢ H2OпјҲжңӘй…Қе№іпјү дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺFe2O3еҸ‘з”ҹж°§еҢ–еҸҚеә”пјҢиў«иҝҳеҺҹВ В В В В В В BпјҺKClOеӨұеҺ»з”өеӯҗпјҢдҪңж°§еҢ–еүӮ CпјҺиҜҘжқЎд»¶дёӢзҡ„ж°§еҢ–жҖ§пјҡKClOпјңK2FeO4В DпјҺеҸӮеҠ еҸҚеә”зҡ„n(Fe2O3)вҲ¶n(KClO)пјқ1вҲ¶3
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘дёҖе®ҡйҮҸзҡ„FeгҖҒFeOгҖҒFe3O4зҡ„ж··еҗҲзү©дёӯеҠ е…Ҙ100 mL 1 molВ·LвҖҫ1зҡ„зӣҗй…ёпјҢжҒ°еҘҪдҪҝж··еҗҲзү©е®Ңе…Ёжә¶и§ЈпјҢж”ҫеҮә224 mL(ж ҮеҮҶзҠ¶еҶө)зҡ„ж°”дҪ“пјҢеңЁжүҖеҫ—жә¶ж¶ІдёӯеҠ е…ҘKSCNжә¶ж¶Іж— иЎҖзәўиүІеҮәзҺ°гҖӮиӢҘз”Ёи¶ійҮҸзҡ„COеңЁй«ҳжё©дёӢиҝҳеҺҹзӣёеҗҢиҙЁйҮҸзҡ„жӯӨж··еҗҲзү©пјҢиғҪеҫ—еҲ°й“Ғзҡ„иҙЁйҮҸжҳҜ(гҖҖгҖҖ) AпјҺ11.2 gВ В В В В В В В BпјҺ5.6 gВ В В В В В В В В В В В CпјҺ2.8 gВ В В В В В В В В В В В DпјҺж— жі•и®Ўз®—
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
д»ҠжңүдёҖж··еҗҲзү©зҡ„ж°ҙжә¶ж¶ІпјҢеҗ«жңүд»ҘдёӢзҰ»еӯҗдёӯзҡ„иӢҘе№Із§ҚпјҡNa+гҖҒNH4+гҖҒClп№ЈгҖҒBa2+гҖҒHCO3п№ЈгҖҒSO42п№ЈпјҢзҺ°еҸ–дёӨд»Ҫ100m Lзҡ„иҜҘжә¶ж¶ІиҝӣиЎҢеҰӮдёӢе®һйӘҢпјҡ пјҲ1пјү第дёҖд»ҪеҠ и¶ійҮҸNaOHжә¶ж¶ІпјҢеҠ зғӯпјҢ收йӣҶеҲ°ж ҮеҮҶзҠ¶еҶөдёӢзҡ„ж°”дҪ“448mLпјӣ пјҲ2пјү第дәҢд»ҪеҠ и¶ійҮҸBaпјҲOHпјү2жә¶ж¶ІпјҢеҫ—жІүж·Җ4.30gпјҢеҶҚз”Ёи¶ійҮҸзӣҗй…ёжҙ—ж¶ӨгҖҒе№ІзҮҘеҗҺпјҢжІүж·ҖиҙЁйҮҸдёә2.33gпјҺ ж №жҚ®дёҠиҝ°е®һйӘҢпјҢдёӢеҲ—жҺЁжөӢжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү AпјҺBa2+дёҖе®ҡеӯҳеңЁВ В BпјҺ100mLиҜҘжә¶ж¶Ідёӯеҗ«0.01mol HCO3п№ЈВ CпјҺNa+дёҚдёҖе®ҡеӯҳеңЁВ DпјҺClп№ЈдёҚзЎ®е®ҡпјҢеҸҜеҗ‘еҺҹжә¶ж¶ІдёӯеҠ е…ҘAgNO3жә¶ж¶ІиҝӣиЎҢжЈҖйӘҢ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
жҢүиҰҒжұӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
пјҲ4пјүз”Ёеӣӣж°ҜеҢ–зўіиҗғеҸ–жәҙж°ҙеҗҺпјҢеҲҶж¶Іж—¶ж°ҙеұӮд»ҺеҲҶж¶ІжјҸж–—зҡ„ В В В В В пјҲеЎ«вҖңдёӢеҸЈж”ҫеҮәвҖқжҲ–вҖңдёҠ еҸЈеҖ’еҮәпјү пјҲ5пјүе·ҘдёҡдёҠеҲ¶еҚ°еҲ·з”өи·Ҝжқҝж—¶пјҢжҜҸжә¶и§Ј 3.20 g й“ңиҪ¬з§»з”өеӯҗзҡ„зү©иҙЁзҡ„йҮҸжҳҜ В В В В molгҖӮ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘXгҖҒYгҖҒZгҖҒWгҖҒLдёәдә”з§Қзҹӯе‘Ёжңҹе…ғзҙ пјҢйқһйҮ‘еұһе…ғзҙ XжңҖеӨ–еұӮз”өеӯҗж•°дёҺе…¶е‘ЁжңҹеәҸж•°зӣёеҗҢпјҢYзҡ„жңҖеӨ–еұӮз”өеӯҗж•°жҳҜе…¶жүҖеңЁе‘Ёжңҹж•°зҡ„2еҖҚгҖӮYеңЁZдёӯе……еҲҶзҮғзғ§иғҪз”ҹжҲҗе…¶жңҖй«ҳд»·еҢ–еҗҲзү©YZ2гҖӮW+дёҺZ2-е…·жңүзӣёеҗҢзҡ„з”өеӯҗж•°гҖӮXеңЁLдёӯзҮғзғ§пјҢдә§зү©XLжә¶дәҺж°ҙеҫ—еҲ°дёҖз§Қејәй…ёгҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүXеңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®жҳҜ_____гҖӮиҜ·еҶҷеҮәе®һйӘҢе®ӨеҲ¶еӨҮеҚ•иҙЁLзҡ„еҢ–еӯҰж–№зЁӢејҸ______пјҢе°ҫж°”еӨ„зҗҶзҡ„зҰ»еӯҗж–№зЁӢејҸ____________гҖӮ пјҲ2пјүз”ұXеҲҶеҲ«дёҺYгҖҒZеҪўжҲҗзҡ„жңҖз®ҖеҚ•еҢ–еҗҲзү©зҡ„зЁіе®ҡжҖ§е…ізі»дёә___________________гҖӮ пјҲ3пјүз”ұXгҖҒYгҖҒZгҖҒWз»„жҲҗзҡ„дёҖз§ҚзӣҗпјҢеңЁйқўйЈҹдёӯжңүеӨ§йҮҸдҪҝз”ЁпјҢеңЁе…¶ж°ҙжә¶ж¶Ідёӯж»ҙе…Ҙз”ұXгҖҒYгҖҒZеҪўжҲҗзҡ„еҺЁжҲҝдёӯеёёи§Ғзҡ„дёҖз§Қй…ёпјҢеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә______________гҖӮ
|
|
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
йҮҚ铬酸й’ҫпјҲK2Cr2O7пјүжә¶ж¶ІжҳҜе®һйӘҢе’Ңз§‘з ”дёӯдёҖз§Қеёёз”Ёж°§еҢ–еүӮгҖӮй…ёжҖ§жқЎд»¶дёӢпјҢCr2O пјҲ1пјүжҹҗеҗҢеӯҰж¬Із”ЁK2Cr2O7еӣәдҪ“й…ҚеҲ¶500 mL 0.04000 molВ·LпјҚ1зҡ„K2Cr2O7жә¶ж¶ІгҖӮ в‘ йңҖз”Ёзҡ„зҺ»з’ғд»ӘеҷЁжңүзғ§жқҜгҖҒзҺ»з’ғжЈ’гҖҒйҮҸзӯ’гҖҒ В В В В В В В В гҖӮ в‘Ўеә”иҜҘз§°еҸ–K2Cr2O7еӣәдҪ“зҡ„иҙЁйҮҸдёәВ В В В В В В В гҖӮ пјҲ2пјүдәӨиӯҰеёёз”ЁиЈ…жңүйҮҚ铬酸й’ҫй…’зІҫжөӢиҜ•д»ӘжЈҖжөӢеҸёжңәжҳҜеҗҰй…’еҗҺй©ҫиҪҰпјҢе…¶еҢ–еӯҰеҸҚеә”еҺҹзҗҶеҰӮдёӢпјҡ2K2Cr2O7пјӢ3C2H5OHпјӢ8H2SO4===2Cr2(SO4)3пјӢ3CH3COOHпјӢ2K2SO4пјӢ11H2OгҖӮжҜҸжңү1 mol C2H5OHеҸ‘з”ҹеҸҚеә”пјҢиҪ¬з§»з”өеӯҗзҡ„зү©иҙЁзҡ„йҮҸжҳҜВ В В В В В В гҖӮ
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘1 L FeCl3дёҺCuCl2зҡ„ж··еҗҲжә¶ж¶ІпјҲе…¶дёӯCu2+жө“еәҰдёә0.05 molВ·LпјҚ1пјүдёӯеҠ е…ҘдёҖе®ҡйҮҸзҡ„FeзІүпјҢе……еҲҶеҸҚеә”еҗҺиҝҮж»ӨпјҢеү©дҪҷеӣәдҪ“иҙЁйҮҸдёә6.0 gпјҢеҗ‘ж»Өж¶ІдёӯеҠ е…Ҙи¶ійҮҸзҡ„AgNO3жә¶ж¶ІпјҢз”ҹжҲҗ57.4 gжІүж·ҖгҖӮ пјҲ1пјүеү©дҪҷеӣәдҪ“жҲҗеҲҶдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲ2пјүпјҺеҠ е…ҘFeзІүзҡ„иҙЁйҮҸдёәВ В В В В В В В В В g пјҲ3пјүпјҺеҺҹжә¶ж¶ІдёӯFe3+жө“еәҰдёәВ В В В В В В В В В В В В В В molВ·LпјҚ1В В В В В В В пјҲ4пјүпјҺеҸҚеә”еҗҺжә¶ж¶ІдёӯFe2+жө“еәҰдёәВ В В В В В В В В В В В В В В В molВ·LпјҚ1
|
|
| 27. | иҜҰз»ҶдҝЎжҒҜ | |||||||||
|
еҢ–еӯҰеҸҚеә”жҳҜеҢ–еӯҰе®һйӘҢзҺ°иұЎзҡ„жң¬иҙЁпјҢж №жҚ®жҸҸиҝ°еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1) еңЁBaCl2жә¶ж¶ІдёӯйҖҡе…ҘSO2ж°”дҪ“пјҢжңӘи§ҒжІүж·Җз”ҹжҲҗпјҢиӢҘе…ҲйҖҡе…ҘжҲ–еҠ е…ҘдёӢеҲ—зҡ„еҸҰдёҖз§Қзү©иҙЁпјҢеҶҚйҖҡе…ҘSO2дёҚиғҪзңӢеҲ°жІүж·Җзҡ„жңү____________(еЎ«еәҸеҸ·)гҖӮ в‘ Cl2гҖҖв‘ЎNaOHгҖҖв‘ўHClгҖҖв‘ЈFeCl3жә¶ж¶ІгҖҖв‘ӨCO2гҖҖв‘ҘH2SгҖҖв‘ҰNH3гҖҖ⑧NaClOжә¶ж¶І (2) еӣҫдёӯAгҖҒBгҖҒCд№Ӣй—ҙжңүд»ҘдёӢзҡ„иҪ¬еҢ–е…ізі»(еүҜдә§зү©е·Із•ҘеҺ»)пјӣ
еҲҷдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ____________гҖӮ aпјҺиӢҘAжҳҜйқһйҮ‘еұһеҚ•иҙЁпјҢеҲҷCдёҺж°ҙеҸҚеә”зҡ„з”ҹжҲҗзү©еҸҜиғҪжҳҜејәй…ёжҲ–ејұй…ё bпјҺиӢҘAжҳҜйҮ‘еұһеҚ•иҙЁпјҢеҲҷCдёҺж°ҙеҸҚеә”зҡ„з”ҹжҲҗзү©еҸҜиғҪжҳҜејәзўұ cпјҺиӢҘAжҳҜеҢ–еҗҲзү©пјҢеҲҷCдёҺж°ҙеҸҚеә”зҡ„з”ҹжҲҗзү©еҸҜиғҪжҳҜејәй…ё (3) зҰ»еӯҗж–№зЁӢејҸжҳҜйҮҚиҰҒзҡ„еҢ–еӯҰз”ЁиҜӯгҖӮдёӢеҲ—жҳҜжңүе…ізҰ»еӯҗж–№зЁӢејҸзҡ„дёҖдәӣй”ҷиҜҜи§ӮзӮ№пјҢиҜ·еңЁдёӢеҲ—иЎЁж јзӣёеә”зҡ„вҖңзҰ»еӯҗж–№зЁӢејҸвҖқеҗҰе®ҡиҝҷдәӣи§ӮзӮ№гҖӮ еҸҚеә”зү©д»ҺдёӢеҲ—зү©иҙЁдёӯйҖүеҸ–пјҡNaгҖҒFeгҖҒH2OгҖҒH2SO4гҖҒHClгҖҒNaOHгҖҒBa(OH)2гҖҒCuSO4 В
|
||||||||||
| 28. | иҜҰз»ҶдҝЎжҒҜ | |||
|
дёәиҝӣиЎҢжҹҗдәӣе®һйӘҢзҡ„жҺўз©¶пјҢжҹҗе…ҙи¶Је°Ҹз»„и®ҫи®ЎдәҶеҰӮдёӢиЈ…зҪ®гҖӮ
пјҲ1пјүдёәжҺўз©¶жө“зЎ«й…ёдёҺжңЁзӮӯеҸҚеә”зҡ„е…ЁйғЁдә§зү©пјҢеҲҶж¶ІжјҸж–—дёӯзӣӣжө“зЎ«й…ёпјҢеңҶеә•зғ§з“¶дёӯж”ҫжңЁзӮӯгҖӮ в‘ иЈ…зҪ®BдёӯиҜ•еүӮзҡ„еҗҚз§°жҳҜВ В В В В В В гҖӮ в‘ЎиЈ…зҪ®CгҖҒDгҖҒEдёӯжүҖзӣӣж”ҫзҡ„иҜ•еүӮеҲҶеҲ«жҳҜе“ҒзәўгҖҒй…ёжҖ§KMnO4жә¶ж¶Іе’Ңжҫ„жё…зҡ„зҹізҒ°ж°ҙгҖӮCиЈ…зҪ®зҡ„дҪңз”ЁжҳҜВ В В В В В В пјҢзЎ®и®Өдә§зү©дёӯеҗ«жңүCO2зҡ„е®һйӘҢзҺ°иұЎжҳҜВ В В В В В В гҖӮ пјҲ2пјүдёәдәҶеҲ¶еҸ–ж— ж°ҙж°ҜеҢ–й“ңпјҢдёҠиҝ°иЈ…зҪ®дёӯзҡ„еҲҶж¶ІжјҸж–—дёӯзӣӣжө“зӣҗй…ёпјҢеңҶеә•зғ§з“¶дёӯж”ҫMnO2пјҢBдёӯж”ҫй“ңзІү并еңЁзҺ»з’ғз®ЎдёӢж·»еҠ й…’зІҫзҒҜпјҢдё”е°ҶBиЈ…зҪ®е№із§»иҮіDдёҺEд№Ӣй—ҙгҖӮ в‘ жӯӨж—¶CгҖҒDдёӯдҫқж¬ЎеҠ е…Ҙзҡ„иҜ•еүӮеҲҶеҲ«жҳҜВ В В В В В В гҖӮ в‘ЎиӢҘEдёӯдёәNaOHжә¶ж¶Із”ЁдәҺе°ҫж°”еҗёж”¶пјҢеёёжё©дёӢеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәВ В В В В В В гҖӮ в‘ўе®һйӘҢз»“жқҹж—¶пјҢеә”йҰ–е…ҲзҶ„зҒӯиЈ…зҪ®BдёӢйқўзҡ„й…’зІҫзҒҜпјҢе…¶зӣ®зҡ„жҳҜВ В В В В В В гҖӮ
|
||||
| 29. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁеҠ зғӯжқЎд»¶дёӢпјҢз”ЁдәҢж°§еҢ–й”°дёҺи¶ійҮҸжө“зӣҗй…ёеҸҚеә”пјҢеҲ¶еҫ—ж°Ҝж°”0.56LпјҲж ҮеҮҶзҠ¶еҶөпјүгҖӮй—®пјҡ пјҲ2пјүзҗҶи®әдёҠйңҖиҰҒж¶ҲиҖ—MnO2дёәВ В В В В В В В В пјҲ3пјүиў«ж°§еҢ–зҡ„HClзҡ„зү©иҙЁзҡ„йҮҸжҳҜВ В В В В В В В В В В В
|
|
- 2018-2019е№ҙй«ҳдәҢдёҠеӯҰжңҹ第дёүж¬ЎжңҲиҖғеҢ–еӯҰиҜ•еҚ·е®Ңж•ҙзүҲпјҲж№–еҚ—зңҒйӮөйҳіеёӮйӮөдёңеҺҝ第дёҖдёӯеӯҰпјү
- д№җеұұеёӮй«ҳдёүеҢ–еӯҰ2019е№ҙдёӢеҚҠе№ҙжңҲиҖғжөӢйӘҢе®Ңж•ҙиҜ•еҚ·
- еӣӣе·қзңҒжҲҗйғҪеёӮ第дёғдёӯеӯҰ2020еұҠй«ҳдёүдёҠеҚҠжңҹе…ҘеӯҰиҖғиҜ•еҢ–еӯҰж— зәёиҜ•еҚ·е®Ңж•ҙзүҲ
- й«ҳдёҖдёӢеӯҰжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•йўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲ2019-2020е№ҙжұҹиҘҝзңҒж–°дҪҷеёӮпјү
- з”ҳиӮғ2019е№ҙй«ҳдёҖдёҠеҚҠжңҹеҢ–еӯҰжңҹжң«иҖғиҜ•еҗҢжӯҘз»ғд№
- жІіеҚ—2020е№ҙй«ҳдәҢеҢ–еӯҰдёӢеҚҠжңҹжңҹдёӯиҖғиҜ•зҪ‘дёҠиҖғиҜ•з»ғд№
- 2019-2020е№ҙй«ҳдәҢдёҠеҚҠе№ҙжңҹдёӯиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·пјҲзҰҸе»әзңҒиҺҶ田第дёғдёӯеӯҰпјү
- еҗүжһ—2019е№ҙй«ҳдәҢеҢ–еӯҰдёӢжңҹжңҹдёӯиҖғиҜ•зҪ‘дёҠиҖғиҜ•з»ғд№

 В В В В В
В В В В В  В В В В В В В В В В
В В В В В В В В В В  В В В В
В В В В