乐山市高三化学2019年下半年月考测验完整试卷
| 1. 选择题 | 详细信息 |
|
化学与社会密切相关,下列说法错误的是 A. 用硫酸可以洗去锅炉水垢 B. 用加热的方法可以杀死流感病毒 C. 食盐既可做调味品,也可以做防腐剂 D. 洗涤棉制品可以使用弱碱性洗涤剂或肥皂 |
|
| 2. 选择题 | 详细信息 |
|
化学与生产生活密切相关,下列说法不正确的是 A. “卤水点豆腐”运用了胶体电泳的性质 B. C. NaCl既可以做调味品,也可以做食品防腐剂 D. 清乾隆“瓷母”是指各种釉彩大瓶,它们的主要成分是硅酸盐 |
|
| 3. 选择题 | 详细信息 |
|
在给定条件下,下列选项所示的物质间转化均能实现的是( ) A. N2(g) B. Fe(s) C. MgO(s) D. S(s) |
|
| 4. 选择题 | 详细信息 |
|
下列物质既能与盐酸反应,又能与氢氧化钠溶液反应,且既不是电解质也不是非电解质的是 A. SiO2 B. Al C. NaHCO3 D. Al2O3 |
|
| 5. 选择题 | 详细信息 |
|
下列关于物质分类的说法正确的是( ) A. 胆矾、石膏、漂白粉都是纯净物 B. 氢氧化钙、盐酸、硫酸铜均为强电解质 C. 熟石灰、烧碱、纯碱都是碱 D. 玻璃、水泥、陶瓷都是传统无机非金属材料 |
|
| 6. 选择题 | 详细信息 |
|
下列变化属于物理变化的是 A. 粮食酿酒 B. 煤的干馏 C. 钢铁生锈 D. 石油分馏 |
|
| 7. 选择题 | 详细信息 |
|
下列各组离子,因发生氧化还原反应而不能大量共存的是 A. K+、Fe3+、SCN–、Cl– B. Fe3+、K+、OH–、SO42– C. Fe2+、K+、Cl–、MnO4– D. Na+、H+、SO42–、CO32– |
|
| 8. 选择题 | 详细信息 |
|
常温下,下列各组离子在指定溶液中一定能大量共存的是 A.澄清透明的中性溶液中:Fe3+、Ba2+、NO3-、Cl- B.使甲基橙变黄色的溶液中: Na+、AlO2-、SO42-、Cl- C.c(OH–)=1×10-13mol/L的溶液中: NH4+、Ca2+、Cl-、NO3- D.能使红色石蕊试纸变为蓝色的溶液:Na+、Cl−、S2−、ClO− |
|
| 9. 选择题 | 详细信息 |
|
下列说法正确的是 A.液态HCl、固态AgCl均不导电,所以HCl、AgCl是非电解质 B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 C.碱性氧化物一定是金属氧化物,金属氧化物一定是碱性氧化物 D.非金属氧化物不一定是酸性氧化物,酸性氧化物不一定都是非金属氧化物 |
|
| 10. 选择题 | 详细信息 |
|
下列指定反应的离子方程式正确的是 A. 硫化氢通入CuSO4溶液中:H2S+Cu2++SO42-=CuS↓+H2SO4 B. 向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3++4NH3·H2O=AlO2-+4NH4++2H2O C. 在酸性溶液中,KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O D. 向CuSO4 溶液中加入NaOH:Cu2++2OH-=Cu(OH)2↓ |
|
| 11. 选择题 | 详细信息 |
|
下列溶液中Cl-浓度最小的是 A. 100mL 2mol/L MgCl2溶液 B. 800mL 2.5mol/L NaCl溶液 C. 10mL 5mol/L KCl溶液 D. 450mL 1mol/L AlCl3溶液 |
|
| 12. 选择题 | 详细信息 |
|
关于Na2O2的有关叙述错误的是 A. 阳离子与阴离子个数比为2:1 B. 常用于对自来水杀菌消毒 C. 久置于空气中,最终变为Na2CO3 D. 1molNa2O2与足量的CO2和水蒸气的混合气体充分反应,转移1mol电子 |
|
| 13. 选择题 | 详细信息 |
|
已知2MO4n-+5S2-+16H+=2M2++5S↓+8H2O,则MO4n-中M的化合价为( ) A. +3 B. +4 C. +6 D. +7 |
|
| 14. 选择题 | 详细信息 |
|
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( ) A. 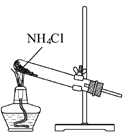 制取氨气 B. 制取氨气 B. 制取NaHCO3 制取NaHCO3C. 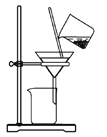 分离NaHCO3 D. 分离NaHCO3 D.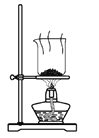 干燥NaHCO3 干燥NaHCO3 |
|
| 15. 填空题 | 详细信息 |
|
实验室需要90mL 2.0mol/L的Na2CO3溶液,现用无水碳酸钠粉末配制;请回答下列问题: (1)应称取___ 无水碳酸钠. (2)下列仪器中,一定不会用到的是______________________________________ A.50mL容量瓶 B.100mL容量瓶 C.玻璃棒; D.50mL量筒 E.托盘天平 F.药匙 (3)容量瓶在使用前必须进行的操作是___ . (4)配制过程简述为以下各步:其正确的操作顺序为______(填各步骤序号). A.冷却至室温 B.洗涤并转移 C.称量 D.溶解 E.摇匀装瓶 F.定容 G.转移 (5)在溶液配制过程中,下列情况会使所配溶液浓度偏高的是______ . A.溶解固体后的溶液未冷却至室温就移入容量瓶中定容 B.容量瓶在使用前未干燥,里面有少量蒸馏水 C.称量时,砝码生了锈 D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理 E.转移时不小心有溶液溅出瓶外 F.定容时俯视容量瓶的刻度线 (6)在上述所配的Na2CO3溶液中Na+的物质的量浓度为___ , 取上述Na2CO3溶液50mL与足量的盐酸反应生成的CO2气体在标况下的体积为___ . |
|
| 16. 综合题 | 详细信息 |
|
Ⅰ(1)标准状况下,1.7 g NH3与_______L H2S气体含有的氢原子数相同。 (2)2 mol的CO2与3 mol的SO3的原子数之比是__________。 (3)常温常压下22.4升CO2中分子个数___64克SO2的分子个数(填“>、<或=”) (4)标准状况下,33.6L的NH3所含电子的物质的量约为______mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为__________mol/L (5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为________。 (6)某盐混合溶液中含有离子:Na+、Mg2+、Cl﹣、SO42﹣,测得Na+、Mg2+ 和Cl﹣的物质的量浓度依次为:0.2mol•L﹣1、0.25mol•L﹣1、0.4mol•L﹣1,则c(SO42﹣)=__________. (7)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为_____________。 (8)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为_________________,NH3的体积分数为______________. (9)VmLAl2(SO4)3溶液中含Al3+ ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度是_____________mol/L。 Ⅱ.请按照要求完成下列方程式。 (1)写出泡沫灭火器反应原理的离子方程式:_______________________________________。 (2)铁与水蒸气高温下反应的化学方程式:____________________________________________。 (3)NaCN属于剧毒物质,有一种处理方法其原理为CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,另一种与H+作用产生能使品红溶液褪色的刺激性气体,写出CN-与S2O32-反应的离子方程式:___________________________________。 (4)亚硝酸盐是毒性较强的物质,其具有较强的还原性,将亚硝酸钠溶液滴加到K2Cr2O7酸性溶液(橙色)中,溶液由橙色变为绿色(Cr3+),试写出反应的离子方程式:__________________________。 (5)将NaHSO4溶液滴入氢氧化钡溶液中至中性的离子反应方程式:_____________________。 |
|
| 17. | 详细信息 |
工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如图: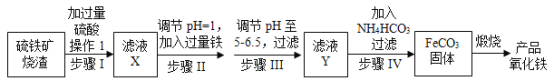 试回答下列问题: (1)滤液X中含有的金属阳离子是___(填离子符号)。 (2)步骤Ⅱ中发生反应的离子方程式为_____。 (3)步骤Ⅲ中最好可选用___(填字母)调节溶液的pH。 A.稀硝酸 B.氨水 C.氢氧化钠溶液 D.高锰酸钾溶液 (4)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是___。 (5)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是______。 (6)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为_____。 |
|
最近更新



