甘肃2019年高一上半期化学期末考试同步练习
| 1. 选择题 | 详细信息 |
|
中华民族有着光辉灿烂的历史,下列有关描述不涉及氧化还原反应的是( ) A. 用胆矾湿法炼铜 B. 用铁矿石高炉炼铁 C. “爆竹声中一岁除,春风送暖入屠苏” D. 只要功夫深,铁杵磨成针 |
|
| 2. 选择题 | 详细信息 |
|
在实验室中,对下列事故或药品的处理正确的是( ) A. 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 B. 金属钠着火燃烧时,用泡沫灭火器灭火 C. 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 D. 含硫酸的废液倒入水槽,用水冲入下水道 |
|
| 3. 选择题 | 详细信息 |
|
在自然界中,既有以游离态形式存在,又有以化合态形式存在的元素是( ) A. 硫 B. 硅 C. 氯 D. 铝 |
|
| 4. 选择题 | 详细信息 |
|
设NA代表阿伏加德罗常数,下列说法正确的是( ) A. 含有4molHCl的浓盐酸与足量MnO2反应,生成1molCl2 B. 78g Na2O2与足量水充分反应时电子转移数为2NA C. 标准状况下,22.4L SO3中所含的SO3分子数为NA D. 常温常压下,8g O2所含的质子数为4NA |
|
| 5. 选择题 | 详细信息 |
|
关于物质的用途下列说法正确的是 ①水玻璃是制备硅胶和木材防火剂的原料;②氢氧化铝可以用做耐火材料;③氢氟酸可以用来刻蚀玻璃;④纯净的二氧化硅是制备光导纤维的原料;⑤利用氯气的毒性可以消灭田鼠;⑥漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂;⑦四氧化三铁常用作红色油漆和涂料⑧晶体硅是良好的半导体材料,可以制成光电池 A.①②③④⑤⑥ B.①③④⑤⑥⑧ C.①②④⑤⑥⑦ D.③④⑤⑥⑦⑧ |
|
| 6. 选择题 | 详细信息 |
|
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O ,下列说法不正确的是( ) A. KClO3在反应中得电子 B. ClO2是还原产物 C. H2C2O4在反应中被氧化 D. 1molKClO3参加反应有2mole-转移 |
|
| 7. 选择题 | 详细信息 |
|
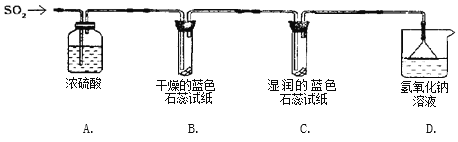
下列四组实验中,操作正确且能达到预期目的是() A. 配制稀硫酸 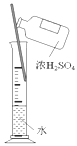 B. 固体NaHCO3分解 B. 固体NaHCO3分解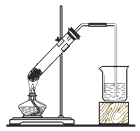 C. 制备Fe(OH)2沉淀 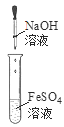 D. 收集SO2(a处进入) D. 收集SO2(a处进入)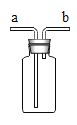 |
|
| 8. 选择题 | 详细信息 |
|
下列实验现象与对应化学方程式都正确的是( ) A. 钠投入水中,浮在水面熔成小球,在水面快速移动,得到的溶液显碱性;2 Na + 2 H2O B. 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2 + Cl2 C. FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色; 2Fe(OH)2 + O2 + H2O D. 向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有硅酸胶体产生;Na2SiO3 + 2HCl |
|
| 9. 选择题 | 详细信息 |
|
下列鉴别方法不能达到实验目的的是 ( ) A. 用丁达尔效应鉴别淀粉溶液和氯化钠溶液 B. 用NaOH溶液鉴别硫酸铝和硫酸镁两种无色溶液 C. 用品红溶液鉴别SO2和CO2两种无色气体 D. 用焰色反应鉴别碳酸氢钠和碳酸钠两种无色溶液 |
|
| 10. 选择题 | 详细信息 |
|
只用一种试剂,可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3四种溶液,这种试剂是 A. Ba(OH)2 B. H2SO4 C. AgNO3 D. NaOH |
|
| 11. 选择题 | 详细信息 |
|
下列各组离子在溶液中一定能够大量共存的是 A. 在含有大量OH-的溶液中:NO3-、Na+、Cl-、AlO2- B. 在强酸性溶液中: K+、HCO3-、SO42- 、ClO- C. 在含有大量SO42-的无色溶液中:Mg2+、Na+、Cu2+、Cl- D. 在含有大量Fe2+的溶液中:H+、Na+、Cl-、ClO- |
|
| 12. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. H2、SO2、CO2三种气体都可用于浓硫酸干燥 B. SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 C. Al2O3和MgO均可与NaOH溶液反应 D. SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
|
| 13. 选择题 | 详细信息 |
|
下列反应的离子方程式书写正确的是 A. 锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag B. 碳酸氢钙溶液加入醋酸中:Ca(HCO3)2+2CH3COOH=Ca2++2CH3COO-+2CO2↑+2H2O C. 金属铝加入到浓碱溶液中:2Al+2OH-=2AlO2-+3H2↑ D. 铜粉加入到氯化铁溶液中:Cu+2Fe3+=Cu2++2Fe2+ |
|
| 14. 选择题 | 详细信息 |
|
下列说法中正确的是 ( ) A. 向久置的氯水中滴入紫色石蕊试液,溶液先变红后褪色 B. pH在5.6~7之间的降水通常称为酸雨 C. 合金的熔点一般比成分金属的低 D. 硫粉在过量的纯氧中燃烧可生成SO3 |
|
| 15. 选择题 | 详细信息 | ||||||||||||||||||||
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
|
|||||||||||||||||||||
| 16. 选择题 | 详细信息 |
|
用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是 ( ) A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥ |
|
| 17. 选择题 | 详细信息 |
|
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析正确的是( ) A. 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 B. 通入SO2时,SO2与I2反应,I2作还原剂 C. 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 D. 滴加KI溶液时,转移2 mol e-时生成1 mol白色沉淀 |
|
| 18. 选择题 | 详细信息 |
|
将一定量的氯气通入60mL10mol/L.热的NaOH浓溶液中,恰好完全反应,溶液中形成NaCl、NaClO 和NaClO3的共存体系。下列判断正确的是 A. 与NaOH反应的氯气一定为0.3mol B. 反应后的溶液中,n(Na+): n(Cl-)可能为7 :3 C. 该反应的氧化产物为NaClO3 D. n(NaCl):n(NaClO) :n(NaClO3)可能为11: 2: 1 |
|
| 19. 选择题 | 详细信息 |
|
已知某厂排放的尾气中NO、NO2的体积比为1:1,该厂采用NaOH溶液来处理该尾气,处理后所得溶液中只有一种含氮的钠盐。则该含氮的钠盐中,氮元素的化合价为( ) A. -3 B. +1 C. +3 D. +5 |
|
| 20. 选择题 | 详细信息 |
|
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为 ( ) A. |
|
| 21. 填空题 | 详细信息 |
|
(1)将硅酸盐Ca2Mg3Fe2(Si4O11)2(OH)2改写成氧化物的形式:________________________ 。 (2)用化学方程式表示生活中漂白粉的作用原理:__________________________________。 (3)选择合适的试剂除去下列各物质中的杂质(括号内为杂质),并写出相应方程式。 ①CO2(HCl)____________, 离子方程式: ________________________________。 ②SiO2(CaO)___________, 离子方程式:_________________________________。 ③NO(NO2)____________, 化学方程式:_________________________________。 |
|
| 22. 推断题 | 详细信息 |
|
已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下: ①A+B→白色沉淀,加入稀硝酸,沉淀不溶解. ②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色. ③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失. (1)则各是什么物质的化学式为:A 、B 、C 、D . (2)现象②中所发生的反应的化学方程式为: 、 . (3)现象③中所发生反应的离子方程式为: 、 . |
|
| 23. 实验题 | 详细信息 | ||||||||
下表是某城市某日空气质量报告:
|
|||||||||
| 24. 计算题 | 详细信息 |
|
用MnO2 和浓盐酸反应制Cl2,当有0.4molHCl被氧化时,生成的Cl2全部用石灰水吸收,则计算: (1)制Cl2的反应中转移电子的数目? (2)生成Cl2的体积(标准状况下)? (3)制得漂白粉[CaCl2和Ca( ClO)2的混合物]的质量? (写出计算过程) |
|