2018河北高二上学期人教版高中化学期中考试
| 1. | 详细信息 | ||||
|
在25℃时,某溶液中由水电离出的c[H+]=1×10-12mol•L-1,则该溶液的pH可能是( )
|
|||||
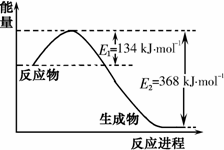
| 2. | 详细信息 | ||||
|
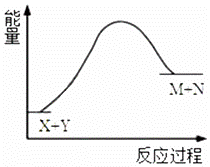
已知X+Y→M+N反应中的能量变化过程如图,则下列推断一定正确的是( )
|
|||||
| 3. | 详细信息 | ||||
|
已知反应:
|
|||||
| 4. | 详细信息 | ||||
|
25℃、101kPa下,4g CH4完全燃烧生成CO2和液态H2O时,放出222.5kJ的热量,则下列热化学方程式中正确的是( )
|
|||||
| 5. | 详细信息 | ||||
|
MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示.下列叙述中正确的是( )
|
|||||
| 6. | 详细信息 | ||||
|
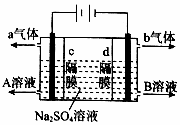
利用三室式电解池(装置结构如图所示,电极均为惰性电极)可以实现用硫酸钠溶液制取硫酸和氢氧化钠.下列叙述正确的是( )
|
|||||
| 7. | 详细信息 | ||||
|
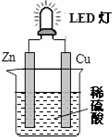
LED灯既能节能、亮度又好.图是某课外活动小组设计的用化学电源使LED灯发光的装置.下列说法正确的是( )
|
|||||
| 8. | 详细信息 | ||||
|
在密闭容器中,反应2SO2(g)+O2(g)=2SO3(g)达到平衡后,若将容器体积缩小一半,对反应产生的影响是( )
|
|||||
| 9. | 详细信息 | ||||
|
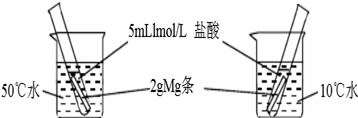
控制变量法是化学实验的常用方法之一.下图实验探究影响反应速率的因素是
|
|||||
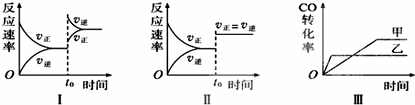
| 10. | 详细信息 | ||||
|
X、Y、Z三种气体进行下列反应:3X+Y⇌2Z,在三种不同情况下测得的速率值为:
|
|||||
| 11. | 详细信息 | ||||
|
室温下,将 4mol A 气体和 2mol B 气体在 2L 的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌XC(g),经 2s后反应达平衡,测得 C 的浓度为 0.6mol•L-1,B的物质的量为1.4mol,现有下列几种说法:其中正确的是( )
|
|||||
| 12. | 详细信息 |
|
在紫外光照射下,利用WO3/ZnO光催化剂降解酸性橙Ⅱ染料废水的实验所得曲线如图.下列说法错误的是( ) A. 不加催化剂时,紫外光照射降解酸性橙Ⅱ染料废水反应速率较慢 B. 单一ZnO材料也是降解酸性橙Ⅱ染料废水的催化剂 C. 2%WO3/ZnO的催化效果最好 D. 由图中可以看出,光降解酸性橙Ⅱ染料是一个可逆反应
|
|
| 13. | 详细信息 | ||||
|
已知,H2(g)+I2( g)⇌2HI(g)△H<0有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡.欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
|
|||||
| 14. | 详细信息 | ||||
|
已知可逆反应:2N2H4(g)+2NO2(g)⇌3N2(g)+4H2O(g)△H>0.下列有关说法正确的是( )
|
|||||
| 15. | 详细信息 | ||||
|
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0,下列对图象的分析中不正确的是
|
|||||
| 16. | 详细信息 | ||||
|
下列有关合成氨工业的叙述,可用勒夏特列原理来解释的是( )
|
|||||
| 17. | 详细信息 | ||||
|
PH=1的盐酸和醋酸分别加水稀释至PH=4,所需水的体积分别为Va、Vb,则
|
|||||
| 18. | 详细信息 | ||||
|
下列物质中,属于电解质的是( )
|
|||||
| 19. | 详细信息 | ||||
|
下列溶液一定呈酸性的是( )
|
|||||
| 20. | 详细信息 | ||||
|
用pH试纸测量碱溶液的pH时,若事先将pH试纸用蒸馏水润湿,则测量结果会
|
|||||
| 21. | 详细信息 |
|
现有①CH3COOH、②HCl两种溶液,选择填空: |
|
| 22. | 详细信息 |
|
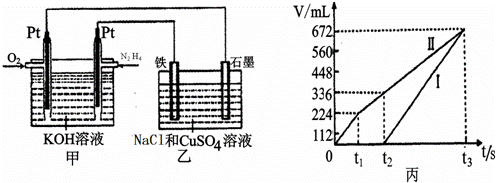
化合物N2 H4做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.某同学设计了一个N2 H4-空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图所示. |
|
| 23. | 详细信息 | ||||||||
|
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程.
已知反应N2(g)+3H2(g)⇌2NH3(g)△H=-93kJ•mol-1.试根据表中所列键能数据,计算a 的数值为 ______ kJ/mol. (2)已知: |
|||||||||
| 24. | 详细信息 | ||||||||
|
氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
①写出该反应的平衡常数表达式.K= ______ . |
|||||||||
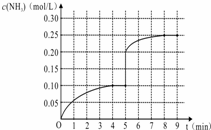
| 25. | 详细信息 |
|
.在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0,反应中NH3的 |
|