安徽2019年高三化学下期开学考试免费检测试卷
| 1. 选择题 | 详细信息 |
|
水对我们的生命起着重要的作用,它是生命的源泉,是人类赖以生存和发展的不可缺少的最重要的物质资源之一。下列关于水的叙述正确的是 A.水是一种重要的溶剂,能溶解所有的无机物和大多数有机物 B.在氧化还原反应中,水只能作氧化剂,不能作还原剂 C.水是一种重要的化学试剂,在一定条件下可与许多无机物和有机物发生反应 D.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等,在上述方法中都有化学反应发生 |
|
| 2. 选择题 | 详细信息 |
|
设阿伏加德罗常数的值为NA,下列有关叙述不正确的是 A.密闭容器中,0.2molNO和0.1 molO2充分反应后,分子总数为0.2NA B.室温下,1 L pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA C.7.8 gNa2S和7.8 gNa2O2中含有阴、阳离子总数均为0.3 NA D.1.0 L1.0 mol/L的NaClO水溶液中含有的氧原子数大于NA |
|
| 3. 选择题 | 详细信息 |
|
某合作学习小组讨论辨析: ①氯化钠固体和氯化氢气体都不导电是因为二者中都不存在离子 ②碳酸钠、氢氧化钡、氯化铵都属于离子化合物 ③醋酸、烧碱和过氧化钠分别属于酸、碱和碱性氧化物 ④氨气、水和硫酸钡分别属于非电解质、弱电解质和强电解质 ⑤碳酸钠晶体在空气中风化是化学变化,硫酸铜晶体溶于水是物理变化 ⑥用玻璃棒蘸取溶液进行焰色反应实验,火焰呈黄色说明溶液中含有Na+ ⑦用Ba(NO3)2溶液、品红试液都可以区分CO2和SO2这两种气体 上述说法正确的是 A.①④⑤⑥ B.②③⑥⑦ C.②③④⑤ D.②④⑤⑦ |
|
| 4. 选择题 | 详细信息 | |||||||||||||||
下列实验操作规范且能达到相应实验目的的是
|
||||||||||||||||
| 5. 选择题 | 详细信息 |
|
有机物X是某种合成药物的中间体,其结构简式如图,关于有机物X的说法正确的是 A.X的分子式为C16H16O3 B.X苯环上的一氯代物同分异构体有2种 C.X既可发生氧化反应,又可发生加成反应 D.X可使酸性KMnO4溶液褪色,不可使溴的CCl4溶液褪色 |
|
| 6. 选择题 | 详细信息 | ||||||||||||||||||||
下列各组澄清溶液中离子能大量共存,且加入(或滴入)X试剂后发生反应的离子方程式书写正确的是
|
|||||||||||||||||||||
| 7. 选择题 | 详细信息 |
|
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3═bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法不正确的是 A.由反应可推断氧化性:HClO4<HClO3 B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5Cl2+I2+6H2O═12H++10Cl-+2IO3- C.若氯酸分解所得混合气体,1 mol混合气体质量为47.6 g,则反应方程式可表示为26HClO3 ═15O2↑+8Cl2↑+10HClO4+8H2O D.若化学计量数a=8,b=3,则该反应转移电子数为20e- |
|
| 8. 选择题 | 详细信息 |
|
2019年是联合国确立的“国际化学元素周期表年”。X、Y、Z、M、R是核电荷数依次增加的五种短周期主族元素。M单质可与化合物ZYX水溶液反应,也可与化合物XR水溶液反应,且均产生X单质。化合物ZYX与化合物XR恰好完全反应后的溶液不能与M单质反应。下列说法正确的是 A.五种元素分别处于不同主族 B.M与Y、M与R形成的化合物中化学键类型相同 C.简单离子半径: X< Z<M< Y< R D.Y、R最简单氢化物的沸点为Y>R |
|
| 9. 选择题 | 详细信息 |
有关下列四组实验描述不正确的是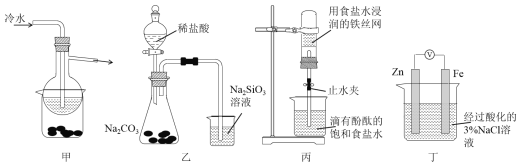 A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl B. 利用装置乙可证明非金属性强弱:Cl>C>Si C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中 D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成 |
|
| 10. 选择题 | 详细信息 |
|
下列分子或离子在指定的分散系中能大量共存的一组是 A.pH=12的溶液:K+、Na+、CH3COO-、Br- B.空气: C2H2、CO2、SO2、NO C.氢氧化铁胶体:H+、K+、S2-、Br- D.高锰酸钾溶液:H+、Na+、SO42-、C2H5OH |
|
| 11. 选择题 | 详细信息 |
实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示: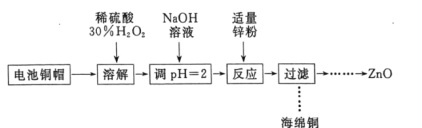 下列叙述错误的是( ) A. “溶解”操作中可用酸性条件下不断鼓入O2代替H2O2 B. 铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的H2O2 C. 与加入锌粉反应的离子为Cu2+、H+ D. “过滤”操作后,将滤液蒸干、高温灼烧即可制取纯净的ZnO |
|
| 12. 选择题 | 详细信息 |
|
下列关于0.5 mol·L-1NaHCO3溶液的说法正确的是 A.溶质的电离方程式为NaHCO3=Na+ + H+ + CO32- B.温度升高,c(HCO3-)增大 C.加水稀释后,n(H+)与n(OH-)的乘积变大 D.离子浓度关系:c(Na+) + c(H+)= c(OH-) + c(HCO3-) + c(CO32-) |
|
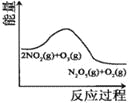
| 13. 选择题 | 详细信息 | ||||||||||||
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)
|
|||||||||||||
| 14. 选择题 | 详细信息 |
|
下列各项反应对应的图像正确的是 A.  保持温度不变,向BaSO4饱和溶液中加入硫酸钠固体 保持温度不变,向BaSO4饱和溶液中加入硫酸钠固体B.  向少量氯化铁溶液中加入铁粉 向少量氯化铁溶液中加入铁粉C.  25℃时,向亚硫酸溶液中通入氯气 25℃时,向亚硫酸溶液中通入氯气D.  向NaAlO2溶液中通入HCl气体 向NaAlO2溶液中通入HCl气体 |
|
| 15. 选择题 | 详细信息 |
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(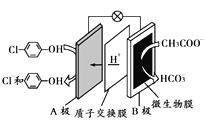 A.该装置为电解装置,B为阳极 B.A极的电极反应式为 C.当外电路中有0.1 mol e-转移时,A极区增加的H+的个数为0.1 NA D.电子从B极沿导线经小灯泡流向A极 |
|
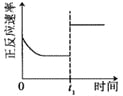
| 16. 选择题 | 详细信息 |
已知:25 ℃时, Kb(NH3·H2O)=1.8×10-5。 该温度下,用 0.100mol·L-1 的氨水滴定 10.00 mL 0.100mol·L-1 的一元酸 HA 的溶液, 滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法不正确的是 A. HA 为强酸 B. a=10 C. 25 ℃时,NH4+的水解平衡常数为 D. 当滴入 20 mL 氨水时,溶液中存在 c(NH4+)>c(A-) |
|
| 17. 推断题 | 详细信息 |
中学化学中几种常见物质的转化关系如下图所示: 已知A是一种单质,将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题: (1)写出C的溶液与双氧水反应的离子方程式:_________________。 (2)写出鉴定E中阳离子的实验方法和现象:________________。 (3)F是一种难溶物质,其溶度积常数为1.0×10-39。向D溶液中加碱调节至pH为_______时,铁离子刚好沉淀完全(离子浓度小于1.0×10-5 mol·L-1时,即可认为该离子沉淀完全)。 (4)已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99 kJ·mol-1,单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H=__________kJ·mol-1。 (5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48L CO2气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是_____________。 |
|
| 18. 实验题 | 详细信息 |
|
(NH4)2Cr2O7可用作有机合成催化剂、媒染剂、显影液等。某化学兴趣小组对(NH4 )2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+ H2O 2CrO42-(黄色)+ 2H+。请回答下列问题: (1)取少量(NH4)2Cr2O7浓溶液于试管中,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是______________。 (2)为探究(NH4)2Cr2O7 (摩尔质量为252 g/mol)加热的分解产物,按下图连接好仪器,加热装置略去,在A中加入5.040 g样品进行实验。 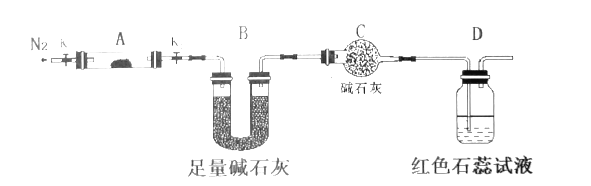 ①仪器A的名称是______________。 ②连接好装置,点燃酒精灯之前,先通入一段时间N2其目的为___________。 ③反应结束后,依然要通一段时间的氮气的原因是________________________。 ④加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为Cr2O3、B中质量的变化为1.44 g,写出重铬酸铵加热分解反应的化学方程式:____________________。 (3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数(杂质不发生反应),其反应原理为 2Ba2++Cr2O72- + H2O = 2BaCrO 4↓+2H+、4NH4++6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mo1 (CH2)6N4H+ 与 1 mo1 H+ 相当],然后用 NaOH 标准溶液滴定反应生成的酸。 实验步骤:称取样品5.600 g,配成500 mL溶液,移取25.00 mL样品溶液于 250 mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10 mL 20.00 mol·L-1的中性甲醛溶液,摇匀、静置5 min后,加入1〜2滴酚酞试液,用0.200 mo1 • L-1 NaOH 标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为16.00 mL。 ①若滴定终点时,俯视读数,则测定结果_____(填“偏大” “偏小”或“无影响”)。 ②滴定计算得该样品中氮的质量分数为___________。 |
|
| 19. | 详细信息 |
我国是干电池的生产和消费大国。某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下: 已知:经过反应Ⅰ后,所有金属元素均以离子形式存在。 回答下列问题: (1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+Zn+2KOH=2MnOOH+K2ZnO2,请写出电池的正极反应式__________。 (2)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应化学方程式________________。 (3)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,请写出该反应的离子方程式______。 (4)反应Ⅲ中X可以是______。(填字母代号) a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3 (5)已知:H2S的电离常数K1=1.0×10−7,K2=7.0×10−15。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”)。 (6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L−1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS−浓度为1.0×10−4 mol·L−1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×10−15] |
|
| 20. 综合题 | 详细信息 | ||||||||||||||
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g) 回答下列问题: (1)写出反应①的热化学方程式(△H用含物理量E的等式表示):___________。 (2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) (3)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)
|
|||||||||||||||