南京市2019年高二化学下册开学考试无纸试卷
| 1. 选择题 | 详细信息 |
|
为纪念日军侵华战争中死难的中国同胞,中国政府设立12月13日为国家公祭日。在侵华史上,日军曾使用芥子气(化学式C4H8Cl2S)屠杀中国军民,下列对芥子气的说法正确的是 A. 有机物 B. 碱 C. 盐 D. 单质 |
|
| 2. 选择题 | 详细信息 |
|
氧元素有16O,17O,18O三种核素,下列对18O 的叙述正确的是 A. 质子数为10 B. 质量数为18 C. 电子数为18 D. 中子数为18 |
|
| 3. 选择题 | 详细信息 |
|
下列关于二氧化硫的说法正确的是 A. 无色无味 B. 密度比空气小 C. 可用排水法收集 D. 有毒 |
|
| 4. 选择题 | 详细信息 |
|
下列物质中含有共价键的离子化合物的是 A. Cl2 B. H2O C. NaCl D. NH4Cl |
|
| 5. 选择题 | 详细信息 |
|
下列语句描绘的变化不属于化学变化的是 A. 蛋白质变性 B. 油脂水解 C. 滴水成冰 D. 钢铁吸氧腐蚀 |
|
| 6. 选择题 | 详细信息 |
|
下列互为同分异构体的一组是 A. 12C和14C B. C2H6和CH4 C. O2和O3 D. CH3CH2OH和CH3OCH3 |
|
| 7. 选择题 | 详细信息 |
|
化学与生活密切相关。下列生活中常见物质与化学式相对应的是 A. 明矾:KAl(SO4)2 B. 水玻璃:CaSiO3 C. 酒精——C2H5OH D. 小苏打:Na2CO3 |
|
| 8. 选择题 | 详细信息 |
|
下列是吸热反应的是 A. Mg+Cl2 C. CaCO3 |
|
| 9. 选择题 | 详细信息 |
|
在强碱性溶液中还可能大量存在的离子是 A. Ba2+ B. Al3+ C. NH4+ D. Fe2+ |
|
| 10. 选择题 | 详细信息 |
|
下列有关物质用途的说法错误的是 A. 液氯可以保存在钢瓶中 B. 二氧化硫具有漂白性,可以用来加工食品,使食品增白 C. 可用铁质容器盛装冷的浓硝酸 D. 液氨常用作制冷剂 |
|
| 11. 选择题 | 详细信息 |
|
不能实现下列物质间直接转化的元素是 单质 A. 钠 B. 碳 C. 硫 D. 铝 |
|
| 12. 选择题 | 详细信息 |
|
影响化学反应速率的因素很多,下列措施能加快化学反应速率的是 A. 增大反应物的用量 B. 升高温度 C. 减小压强 D. 降低反应物浓度 |
|
| 13. 选择题 | 详细信息 |
|
下列关于乙烯的说法正确的是 A. 易溶于水 B. 1 mol乙烯可以加成2mol氢气 C. 易发生取代反应 D. 能使酸性高锰酸钾褪色 |
|
| 14. 选择题 | 详细信息 |
|
下列叙述正确的是 A. 乙酸的结构简式为:C2H4O2 B. 硫离子的结构示意图为: C. NaHCO3电离:NaHCO3=Na++H++CO32- D. H2O的电子式: |
|
| 15. 选择题 | 详细信息 |
|
有关Fe2O3+3CO A. 该反应是置换反应 B. CO是氧化剂 C. CO2是氧化产物 D. 该反应有56gCO参与反应时,电子转移6mol |
|
| 16. 选择题 | 详细信息 |
|
下列有关实验原理或操作正确的是 图1  图2 图2 A. 选择合适的试剂,用图1所示装置可制取和收集少量CO2、NO和O2 B. 实验室制备氢氧化铝时,可向硫酸铝溶液中逐滴加入稀氨水 C. 可用图 2装置分离碘和四氯化碳溶液 D. 配制100mL 0.1 mol/L NaCl溶液时,用托盘天平准确称取NaCl固体5.85g |
|
| 17. 选择题 | 详细信息 |
|
用NA表示阿伏加德罗常数的值。下列判断正确的是 A. 活泼金属与盐酸反应置换生成1mol H2时,转移电子数是2NA B. 22.4 L氢气中,含有的氢原子数是2NA C. 1mol/L的K2SO4溶液中含有的钾离子的物质的量浓度为0.5mol/L D. 在常温常压下,28g CO气体中含有的原子数是NA |
|
| 18. 选择题 | 详细信息 |
|
下列离子方程式正确的是 A. 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O =2AlO2-+3H2↑ B. 钠与水反应:Na+ H2O = Na++OH一+ H2↑ C. 稀硫酸与氢氧化钡溶液反应:H++OH一= H2O D. 铜与氯化铁溶液反应: 3Cu+2Fe3+=2Fe+ 3Cu2+ |
|
| 19. 选择题 | 详细信息 |
某固体酸燃料电池以CHSO4固体为电解质传递OH一,其基本结构见下图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法不正确的是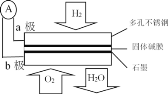 A. 电子通过外电路从a极流向b极 B. b电极为正极 C. a极上的电极反应式为:H2-2e-=== 2 H+ D. 该装置能将化学能转变为电能 |
|
| 20. 选择题 | 详细信息 | ||||||||||||||||||||
下列有关实验操作、 现象和解释或结论都正确的是
|
|||||||||||||||||||||
| 21. 选择题 | 详细信息 |
|
下列属于取代反应的是 A. B. C. 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ D. |
|
| 22. 选择题 | 详细信息 |
|
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,Y、Z、R三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;Z与W在元素周期表中相邻,X的单质是空气的主要成分之一,且其氢化物的水溶液能使酚酞变红。下列说法正确的是 A. 原子半径: R> Z>X B. 气态氢化物的稳定性:W>R C. 最高价氧化物的水化物的碱性:Y>Z D. 工业上电解Z与R的化合物制取Z |
|
| 23. 选择题 | 详细信息 | |||||||||
某硫酸铵样品中混有硫酸氢铵。称取不同质量的样品分别于100mL 2.300mol/L的氢氧化钠溶液充分反应,得到的实验数据入下表:
|
||||||||||
| 24. 填空题 | 详细信息 |
|
(1)据中新社2017年6月29日电,也门遭世界最严重霍乱疫情 1400人死亡疑20余万人感染。霍乱是由霍乱弧菌引起的急性肠道传染病,患者常出现呕吐、腹泻、脱水和高烧等症状,重症和延误治疗可致死亡。据联合国儿童基金会专家表示,正常情况下,霍乱可以预防并且治愈率很高,但由于也门基础设施被完全损坏,将很难控制疾病传播。 请根据此信息和题意回答下列问题(填字母,下同)。 a.蛋白质 b.氨基酸 c.葡萄糖 d.变性 e.盐析 ①霍乱弧菌中的主要成分中含有____________;该成分经水解后变为__________; ②为了预防霍乱,该疫情地区普遍采用喷洒消毒水进行消毒,对所接触到的器具均采用高温灭菌处理,这是因为在高温条件下病毒和细菌都发生了__________。 (2)化学与材料密切相关,材料是人类生存和发展的物质基础。 ①在快中子反应堆中得以广泛应用的钠钾合金在常温下呈液态,这个事实说明合金的熔点比其成分金属的熔点_______(填“高”或者“低”)。 ②有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料而是一种线型高分子化合物,它具有_____________性(选填“热塑”或“热固”)。 ③据报道,每年我国因金属腐蚀造成的损失占国民生产总值(GDP)的4%。钢铁在潮湿的空气中发生________腐蚀时,负极的电极反应为 ______________。 (3)化学与环境紧密联系。 ①空气质量报告的各项指标可以反映出各地空气的质量。下列物质不属于空气污染物的是______(填字母) a.SO2 b.NO2 c.PM2.5 d.CO2 ② 天然水中杂质较多,常需加入明矾,ClO2等物质处理后才能饮用。加入ClO2的作用是__________________;加入明矾后, Al3+水解的离子方程式是 ________________。 ③为减少SO2的排放量,可向煤中加入适量 __________(填名称);也可以将煤气化,即在高温条件下与水蒸气反应转化为水煤气,该反应方程式为___________________。 |
|
| 25. 推断题 | 详细信息 |
有关物质的转化关系如下图所示(部分物质和条件已经略去)。已知D是化学实验室中常见的淡黄色固体,B、C为常见气体单质,F是常见的液体;K是肉类食品常用的食品添加剂。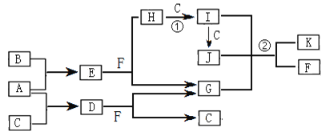 请回答下列问题: (1)D的电子式为_____________。 (2)H的化学式为_____________。 (3)写出反应①的化学方程式:__________________________________________; (4)写出反应②的离子方程式:__________________________________________。 |
|
| 26. | 详细信息 |
|
铝及其化合物在生产生活中有着广泛的用途。 Ⅰ.高岭土化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。用高岭土制备碱式氯化铝的工艺流程如下: 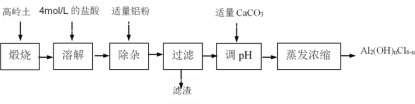 根据流程图回答下列问题: (1)实验室配制4mol/L的盐酸1000mL需要用到的玻璃仪器有烧杯、玻璃棒、量筒、____________________等。 (2)加适量铝粉时所发生的离子反应方程式为________________________________。 Ⅱ.铝和镁的碱式碳酸盐(AlxMgy(OH)z(CO3)w·nH2O)是一种中和胃酸过多的常用药物,某化学兴趣小组通过以下实验探究该药物主要成分的化学式: 甲同学取该碱式盐9.03 g充分灼烧至恒重,测得剩余固体质量为5.13 g; 乙同学取相同质量的碱式盐使其溶于足量的盐酸中,收集到气体体积为336mL(已换算为标准状况);继续向溶液中加入足量的NaOH溶液得到5.22 g白色沉淀。试通过计算确定该碱式碳酸盐的化学式________。(写出计算过程,只有答案不给分) |
|
最近更新



