2018甘肃高三上学期人教版高中化学期中考试
| 1. | 详细信息 |
|
化学与生产、生活、社会密切相关,下列有关说法中正确的是( ) A. Na2FeO4有强氧化性,还原产物又易水解成胶体,是自来水理想的消毒剂和净水剂 B. 玻璃中含有的SiO2可与NaOH溶液反应,故常用NaOH溶液雕刻玻璃纹饰 C. 硅酸盐Na2Fe2Si3O9用氧化物的形式可表示为2FeO • Na2O • 3SiO2 D. 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物合物,也属于离子化合物,其阴阳离子个数比为2 : l,过氧化苯甲酞属于有机物
|
|
| 2. | 详细信息 |
|
分别向CuSO4溶液和FeSO4溶液中加入等量的金属钠,下列说法一定正确的是( ) A. 两溶液中均有金属单质析出 B. CuSO4溶液中最终有蓝色沉淀生成 C. FeSO4溶液中最终有白色沉淀生成 D. 钠在CuSO4溶液中的反应更剧烈
|
|
| 3. | 详细信息 |
|
下列说法不正确的是( ) A. 工业制备镁的原理:MgO(熔融) B. 久罝的硫酸亚铁溶液滴加KSCN溶液,溶液显淡红色 C. SiO2中含Al2O3杂质,可加入足量HCl溶液然后过滤除去 D. 向氯化铵溶液加入浓氢氧化钠溶液,加热,产生的气体使湿润的PH试纸变蓝
|
|
| 4. | 详细信息 |
|
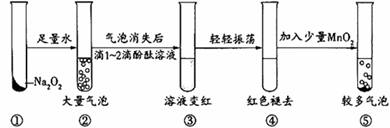
某实验小组通过下图所示实验探究Na2O2与水的反应:
下列说法不正确的是( ) A. ②中的大量气泡主要成分是氧气 B. ③中溶液变红,说明有碱性物质生成 C. ④中现象可能是由于溶液中含有强氧化性物质造成的 D. ⑤中MnO2的主要作用是降低了水中氧气的溶解度
|
|
| 5. | 详细信息 | ||||||||||||||||||||
|
下列实验操作、现象和结论均正确的是( )
|
|||||||||||||||||||||
| 6. | 详细信息 |
|
把400 mL NH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a mol NaOH的溶液恰好反应完全;取另一份加入含b mol HCl的溶液恰好反应完全。该混合溶液中 c(Na+)为( ) A. (10b-5a) mol·L-1 B. (b-0.5a) mol·L-1 C. (
|
|
| 7. | 详细信息 |
|
氮氧化铝(AlON)是一种高硬度防弹材料,可以在高温下由反应Al2O3+C+N2=2AlON+CO合成,下列有关说法正确的是( ) A.氮氧化铝中氮的化合价是-3 B.反应中每生成5.7g AlON 同时生成1.12 L CO C.反应中氧化产物和还原产物的物质的量之比是1:2 D.反应中氮气作还原剂
|
|
| 8. | 详细信息 |
|
下列指定反应的离子方程式正确的是 ( ) A. 钠与水反应: Na +2H2O B. 将少量Na2O2固体加入过量Ba(HCO3)2溶液中: 2Na2O2+4Ba2++4HCO3-=4BaCO3↓+2H2O+O2↑+4Na+ C. 向氢氧化钡溶液中加入稀硫酸: Ba2++OH- + H+ + SO42- D. 向碳酸氢铵溶液中加入足量石灰水: Ca2++ HCO3-+OH-
|
|
| 9. | 详细信息 |
|
化学知识在生产和生活中有着重要的应用。下列说法中正确的是( ) (1)钠的还原性很强;可以用来冶炼金属钛、钽、铌、锆等 (2)K、Na合金可作原子反应堆的导热剂 (3)明矾常作为消毒剂 (4)Na2O2既可作呼吸面具中O2的来源;又可漂白织物、麦杆、羽毛等 (5)碳酸钠在医疗上是治疗胃酸过多的一种药剂 (6)分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 (7)人造刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3。 A. (1)(2)(3)(4) B. (1)(2)(4)(6) C. (1)(2)(4)(6)(7) D. (1)(2)(3)(4)(5)(6)(7)
|
|
| 10. | 详细信息 |
|
下列各组离子一定在指定溶液中大量共存的是( ) ①酸性溶液中:Fe2+,Al3+,NO3-,I-,Cl-,S2- ②室温下,pH=11的溶液中:CO32-,Na+,AlO2-,NO3-,S2-,SO32- ③加入Al能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,NO3- ④使石蕊变红的溶液中:Cu2+,NO3-,Na+,SO42- ⑤室温下,水电离的H+浓度c(H+)=10-12mol/L的溶液中:Cl-,NO3-,NH4+,S2O32- A. ②③④ B. ①②④ C. ②④⑤ D. ②④
|
|
| 11. | 详细信息 |
|
在复杂的体系中,确认化学反应先后顺序有利于解决问题。下列化学反应先后顺序判断正确的是( ) A. 在含有等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:OH-、CO32-、 AlO2- B. 在含等物质的量的FeBr2、FeI2溶液中,缓慢通人氯气:I-、Fe2+、 Br- C. 在含等物质的量的KOH、Ba(OH)2溶液中,缓慢通入CO2: KOH、Ba(OH)2、K2CO3、BaCO3 D. 在含等物质的量的Fe3+、Cu2+、H+溶液中加入锌粉:Cu2+、Fe3+、H+
|
|
| 12. | 详细信息 |
|
将2 mol过氧化钠与4 mol碳酸氢钠固体混合,在密闭容器中,120°C充分反应后,排出气体,冷却,有固体残留。下列分析正确的是( ) A. 残留固体是2 mol Na2CO3 B. 残留固体是Na2CO3和NaOH的混合物 C. 反应中转移2 mol电子 D. 排出的气体是3 mol氧气
|
|
| 13. | 详细信息 |
|
NA为阿伏加德罗常数的值,下列说法正确的是( ) A. 标准状况下,22.4L H2S和SO2的混合气体中含有的分子总数为NA B. 1L1mol•L-1 FeCl3溶液完全水解产生的Fe(OH)3胶体粒子数为NA C. 高温下,16.8gFe与足量的水蒸气完全反应失去的电子数为0.8NA D. 28.6gNa2CO3•10H2O溶于水配成1L溶液,该溶液中阴离子数目为0.1NA
|
|
| 14. | 详细信息 |
|
100 mL含有0.20 mol·L-1碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( ) A. 0.1mol·L-1 B. 0.16 mol·L-1 C. 0.24 mol·L-1 D. 0.2mol·L-1
|
|
| 15. | 详细信息 |
|
将1 mol金属Al全部转化为Al(OH)3,过程中共消耗HCl a mol、NaOH b mol,则a+b最小值为( ) A、1.5 B、6 C、8 D、2
|
|
| 16. | 详细信息 |
|
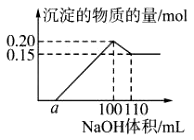
某实验小组对一含有Al 3+ 的未知溶液进行了如下分析:(1)滴入少量氢氧化钠,无明显 变化;(2)继续滴加NaOH溶液,有白色沉淀;(3)滴入过量的氢氧化钠,白色沉淀明显减少。实验小组经定量分析,得出如图所示沉淀与滴入氢氧化钠体积的关系。下列说法正确的是( )
A.该未知溶液中至少含有4种阳离子 B.滴加的NaOH溶液的物质的量浓度为0.5 mol·L -1 C.若另一种离子为二价阳离子,则a=10 D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6g
|
|
| 17. | 详细信息 |
|
甲、乙两烧杯中各盛有100mL3mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉质量为( ) A. 2.7g B. 3.6g C. 1.8g D. 5.4g
|
|
| 18. | 详细信息 |
|
.含n克HNO3的稀溶液恰好与m克Fe完全反应,若HNO3只被还原为NO,则n:m可能 ①5:1、②9:2、③3:1、④2:1、⑤4:1( ) A. ②③ B. ①③④ C. ②③⑤ D. ①③
|
|
| 19. | 详细信息 |
|
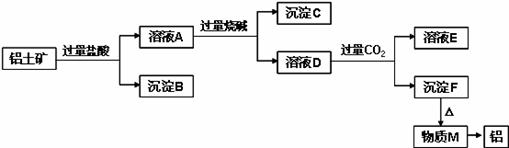
铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:
请回答下列问题: (1)溶液A转化为溶液D发生的离子方程式为____________________; (2)由物质M制取铝的化学方程式为____________________; (3)溶液D中通入过量CO2生成沉淀F的离子方程式为____________________; (4)取一定量的沉淀C置于试管中,逐滴向试管中加入过量HI至沉淀全部溶解,所得溶液中Fe元素以_______存在,检验该离子的实验操作和现象是_________________________ ________________________________________________________________________。
|
|
| 20. | 详细信息 |
|
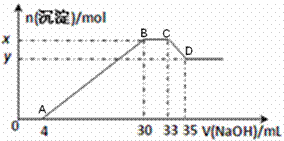
现有100mL含Cu2+、Al3+、NH4+、H+、Cl-的溶液,向该溶液中逐滴加入2.5mol·L-1NaOH溶液,所加NaOH 溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示:
(1)B点的沉淀物的化学式为______________。 (2)原溶液中Cu2+的物质的量为______,原溶液中Cl-物质的量浓度为__________。 (3)原溶液的pH=__________,x-y= _________。 (4)经过滤得到D点的沉淀物,并多次用蒸馏水洗涤沉淀,判断沉淀是否洗涤干净的方法是_________________________________________________________________________
|
|
| 21. | 详细信息 |
|
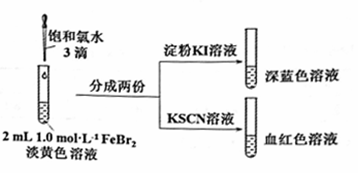
某实验小组探究少量Cl2和FeBr2反应的过程。 (1)配制FeBr2溶液: ⅰ. 配制50mL1.0mol/LFeBr2溶液; ⅱ. 上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。 ①配制50mL1.0mol/LFeBr2溶液常加少量HBr是为了_____________________。 ②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_____________________。 (2)氯气和FeBr2反应实验操作及现象如下:
据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。 ①Cl2和Fe2+发生反应的离子方程式是________________。 ②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。 ③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
|
|
| 22. | 详细信息 | ||||||||||||||||
|
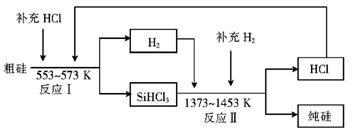
硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用.回答下列问题: (1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有____________________。 (2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图: ⅰ锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下:
②整个制备过程必须严格控制无水。SiCl4遇水剧烈水解生成两种酸,反应的化学方程式是_________________________。 ⅱ 工业上也可以通过如下图所示的流程制取纯硅:
①有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_________;SiHCl3极易水解,其完全水解的化学方程式为___________________________。
② 假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是___________________。
|
|||||||||||||||||