2018至2019年高一下半年期末考试化学题开卷有益(江西省南昌市第十中学)
| 1. 选择题 | 详细信息 |
|
下列说法不正确的是 A. 2CH2=CH2+O2 B. 石油分馏制得汽油、煤油、柴油等产品 C. 煤干馏的产品很多,属于物理变化 D. 煤的气化主要反应是C(s)+H2O(g) |
|
| 2. 选择题 | 详细信息 |
|
下列反应中生成物总能量高于反应物总能量的是 A. 甲烷在O2中的燃烧反应 B. 铁粉溶于稀硫酸 C. Ba(OH)2·8H2O与NH4Cl的反应 D. 盐酸与氢氧化钠反应 |
|
| 3. 选择题 | 详细信息 |
|
下列金属冶炼原理对应的冶炼方法,与工业上冶炼铝相同的是 A. 2NaCl(熔融) C. Fe2O3+3CO |
|
| 4. 选择题 | 详细信息 |
|
下列物质能使酸性高锰酸钾溶液褪色的是 A. 乙烷 B. 乙烯 C. 苯 D. 乙酸 |
|
| 5. 选择题 | 详细信息 |
|
下列反应中,不属于取代反应的是 A. 甲烷和氯气光照下生成四氯化碳 B. 乙烯与氯气反应生成1,2-二氯乙烷 C. 苯与硝酸反应生成硝基苯 D. 乙醇与乙酸反应生成乙酸乙酯 |
|
| 6. 选择题 | 详细信息 |
关于化合物2−苯基丙烯( ),下列说法正确的是 ),下列说法正确的是A. 不能使稀高锰酸钾溶液褪色 B. 易溶于水及甲苯 C. 分子中所有原子共平面 D. 可以发生加成聚合反应 |
|
| 7. 选择题 | 详细信息 |
|
下列叙述中,不正确的是 A. 纤维素、淀粉均属于高分子化合物 B. 浓硝酸沾到皮肤上能使皮肤变黄,这是由于浓硝酸和蛋白质发生了颜色反应 C. 利用油脂在碱性条件下的水解,可以制得肥皂和甘油 D. 糖类、油脂、蛋白质都只由C、H、O三种元素组成的 |
|
| 8. 选择题 | 详细信息 |
|
某种气态烃气体0.1 mol,完全燃烧得0.2mol CO2和3.6 g H2O,下列关于该气体的说法正确的是 A. 甲烷 B. 乙烷 C. 乙烯 D. 丙烯 |
|
| 9. 选择题 | 详细信息 |
|
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是 A. 1/2N2(g)+H2O(g ) ===1/2N2H4(g)+1/2O2(g) ΔH=+267 kJ·mol-1 B. N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-133.5 kJ·mol-1 C. N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1 D. N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-534 kJ·mol-1 |
|
| 10. 选择题 | 详细信息 |
一定条件下水分解生成氢气和氧气,物质和能量的转化关系如图所示,下列判断正确的是 A. △H1 > △H2 B. △H2 < △H3 C. △H1 — △H2 = △H3 D. △H1 + △H3 > △H2 |
|
| 11. 选择题 | 详细信息 |
|
已知:①H2O(g)===H2O(l) ΔH1=-Q1 kJ·mol-1 ②C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1 ③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3=-Q3 kJ·mol-1 若使23 g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为(单位:kJ) A. Q1+Q2+Q3 B. 1.5Q1-0.5Q2+0.5Q3 C. 0.5Q1-1.5Q2+0.5Q3 D. 0.5(Q1+Q2+Q3) |
|
| 12. 选择题 | 详细信息 | ||||||||
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是
|
|||||||||
| 13. 选择题 | 详细信息 |
|
下列各项中表达正确的是 A. NH4Cl的电子式:  B. 原子核内有10个中子的氧原子:188O B. 原子核内有10个中子的氧原子:188OC. 苯的结构简式:C6H6 D. 氟原子结构示意图:  |
|
| 14. 选择题 | 详细信息 |
|
下列各组顺序的排列正确的是 A. 碱性强弱:KOH>NaOH>Mg(OH)2 B. 热稳定性:PH3>H2S>HCl C. 单质氧化性:I2>Br2>Cl2 D. 酸性强弱:HIO4>HBrO4>HClO4 |
|
| 15. 选择题 | 详细信息 | ||||||
如图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B原子的质量数,B原子的原子核内质子数等于中子数。下列叙述正确的是
|
|||||||
| 16. 综合题 | 详细信息 |
|
(1)下列说法不正确的是_________ A.H、D、T表示同一种核素 B.甲烷与正丁烷(CH3CH2CH2CH3)互为同系物 C.金刚石和石墨互为同素异形体 D.乙醇(CH3CH2OH)与二甲醚(CH3-O-CH3)互为同分异构体 (2)金刚石和石墨燃烧,氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。 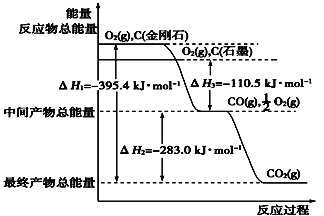 ①在通常状况下,金刚石和石墨中________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH为________。 ②120 g石墨在一定量空气中燃烧,生成气体360g,该过程放出的热量________。 (3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。 N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ·mol-1。 NO分子中化学键的键能为________kJ·mol-1。 (4)综合上述有关信息,请写出CO和NO反应的热化学方程式_______________________。 |
|
| 17. 实验题 | 详细信息 | ||||||||||||||||||||||||||||||
50mL 0.5mol·L-1的盐酸与50mL 0.55mol·L-1的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题: (1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________________。由图可知该装置仍有不妥之处,如不改正,求得的中和热数值会____________(填“偏大”“偏小”“无影响”)。 (2)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):_______________。 (3)取50 mL NaOH溶液和50mL盐酸溶液进行实验,实验数据如下表。 ①请填写下表中的空白:
|
|||||||||||||||||||||||||||||||
| 18. 综合题 | 详细信息 |
|
海洋具有十分巨大的开发潜力,人们可以从海水中获得多种物质.工业上进行海水淡化有多种方法. (1)蒸馏法是历史悠久,技术和工艺比较成熟的海水淡化方法,如图1是海水蒸馏法装置示意图,仪器B的名称是__________。 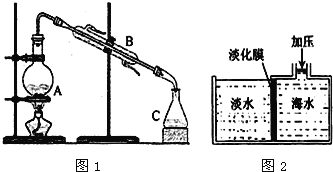 (2)图2是膜分离技术进行淡化的原理示意图,水分子可以透过淡化膜,而海水中其他各种粒子不能通过淡化膜,加压后,右侧海水中减少的是______(填字母)。 A.溶质质量 B.溶剂质量 C.溶质的物质的量浓度 Ⅱ.从海水中提取一些重要的化工产品的工艺流程如图所示。  根据上述流程图回答下列问题: (3)标准状况下22.4 L Cl2气体发生反应②,转移的电子数是________NA。 (4)过程③到过程⑤的变化为“Br-→Br2→Br-→Br2”,其目的是_______________。 (5)过程⑥⑦⑧⑨⑩中没有涉及的化学反应类型是______。 A.分解反应 B.化合反应 C.复分解反应 D.置换反应 (6)写出反应④与⑩的化学方程式 ④________________________________________________; ⑩________________________________________________。 |
|
| 19. 推断题 | 详细信息 |
|
已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平。 现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。 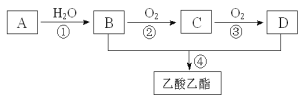 (1)由石油生产A的裂解反应属于_______________(填“化学”或“物理”)变化。 (2)A的结构简式为___________,A在一定条件下可以聚合生成一种常见塑料,该塑料的结构简式为___________。 (3)①的反应类型为__________;D中官能团的名称是__________。 (4)在实验室中获得的乙酸乙酯往往含有B、D,为提纯乙酸乙酯,加入的试剂是_________,分离操作方法是__________。 (5)反应②的化学方程式为__________________________________;反应④的化学方程式为_____________________________________。 |
|
| 20. | 详细信息 | |||||||||||||||
|
工业上可用黄铜矿(CuFeS2)冶炼铜,同时还可得到多种物质。工业冶炼铜的化学方程式是:8CuFeS2+21O2 (1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和____________。 (2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验。  ①滤液中的阳离子有Fe3+、Fe2+、H+、_____________。 ②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是____(填序号)。
|
||||||||||||||||