й«ҳдәҢдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹдёӯиҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еӯҰз”ЁиҜӯдёҚжӯЈзЎ®зҡ„жҳҜ В AпјҺйҶӢй…ёзҡ„з”өзҰ»пјҡCH3COOH В BпјҺзўій…ёж°ўй’ еңЁж°ҙжә¶ж¶Ідёӯзҡ„з”өзҰ»пјҡNaHCO3=Na++HCO3 В CпјҺж°ҜеҢ–й“өзҡ„ж°ҙи§ЈпјҡNH4++H2O В DпјҺзўій…ёй’ҷзҡ„жә¶и§Је№іиЎЎпјҡCaCO3(s)
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
иғҪиҜҒжҳҺд№ҷй…ёжҳҜејұй…ёзҡ„е®һйӘҢдәӢе®һжҳҜ В AпјҺCH3COOHжә¶ж¶ІдёҺZnеҸҚеә”ж”ҫеҮәH2В В В В BпјҺеёёжё©дёӢпјҢ0.1 mol/L CH3COONaжә¶ж¶Ізҡ„pHеӨ§дәҺ7 В CпјҺCH3COO
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁMnSдҪңжІүж·ҖеүӮйҷӨеҺ»е·Ҙдёҡеәҹж°ҙдёӯзҡ„Cu2+пјҡВ Cu2+пјҲaqпјү+MnSпјҲsпјү
В CпјҺиҜҘеҸҚеә”иҫҫеҲ°е№іиЎЎж—¶ cпјҲMn2+пјү=cпјҲCu2+пјүВ В DпјҺиҜҘеҸҚеә”зҡ„е№іиЎЎеёёж•°
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүзӯүдҪ“з§ҜгҖҒзӯүpHзҡ„CaпјҲOHпјү2гҖҒKOHе’ҢNH3вҖўH2Oдёүз§Қзўұжә¶ж¶ІпјҢж»ҙеҠ зӯүжө“еәҰзҡ„зӣҗй…ёе°Ҷе®ғ们жҒ°еҘҪдёӯе’ҢпјҢ з”ЁеҺ»й…ёзҡ„дҪ“з§ҜеҲҶеҲ«дёәV1гҖҒV2гҖҒV3пјҢеҲҷдёүиҖ…зҡ„еӨ§е°Ҹе…ізі»жӯЈзЎ®зҡ„жҳҜ В В AпјҺV3пјһV2пјһV1 В В В В В В BпјҺV3=V2=V1В В В В В CпјҺV3пјһV2=V1 В В В В В DпјҺV1=V2пјһV3
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
еҜ№дәҺзғғзҡ„е‘ҪеҗҚжӯЈзЎ®зҡ„жҳҜ
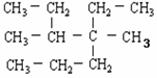
В BпјҺ3п№Јз”Іеҹәп№Ј2пјҢ3п№ЈдәҢд№ҷеҹәе·ұзғ· В CпјҺ4пјҢ5п№ЈдәҢз”Іеҹәп№Ј4п№Јд№ҷеҹәеәҡзғ·В В DпјҺ3пјҢ4п№ЈдәҢз”Іеҹәп№Ј4п№Јд№ҷеҹәеәҡзғ·
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗдёҖе…ғејәзўұMOHжә¶ж¶ІеҠ е…ҘжҹҗдёҖе…ғй…ёHAеҸҚеә”еҗҺпјҢжә¶ж¶Іе‘ҲдёӯжҖ§пјҢдёӢеҲ—еҲӨж–ӯдёҖе®ҡжӯЈзЎ®зҡ„жҳҜ В AпјҺеҠ е…Ҙзҡ„й…ёиҝҮйҮҸВ В В В В В В В В В В В В В В В В В BпјҺз”ҹжҲҗзҡ„зӣҗдёҚж°ҙи§Ј В CпјҺй…ёе’Ңзўұзӯүзү©иҙЁзҡ„йҮҸж··еҗҲВ В В В В В В В В В DпјҺеҸҚеә”еҗҺжә¶ж¶ІдёӯcпјҲAп№Јпјү=cпјҲM+пјү
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ25в„ғж—¶пјҢжө“еәҰеқҮдёә1mol/Lзҡ„пјҲNH4пјү2SO4гҖҒпјҲNH4пјү2CO3гҖҒпјҲNH4пјү2FeпјҲSO4пјү2дёүз§Қжә¶ж¶ІдёӯпјҢжөӢеҫ—е…¶дёӯcпјҲNH4+пјүеҲҶеҲ«дёәa mol/LгҖҒb mol/LгҖҒc mol/LпјҢеҲҷдёӢеҲ—еҲӨж–ӯжӯЈзЎ®зҡ„жҳҜ В В AпјҺaпјһbпјһcВ В В В В В В В В BпјҺaпјһcпјһbВ В В В В В В В CпјҺbпјһaпјһcВ В В В В DпјҺcпјһaпјһb
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢпјҢжңүдёӢеҲ—еӣӣз§Қжә¶ж¶Іпјҡв‘ В В в‘ўpHпјқ12зҡ„NaOHжә¶ж¶Іпјӣв‘ЈpHпјқ12зҡ„ж°Ёж°ҙгҖӮдёӢеҲ—жңүе…іиҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ В В AпјҺеӣӣз§Қжә¶ж¶Ідёӯзҡ„KWзӣёеҗҢпјҢз”ұж°ҙз”өзҰ»еҮәзҡ„cпјҲHпјӢпјүпјҡв‘ пјқв‘Ўпјқв‘ўпјқв‘Ј В В BпјҺеҸ–дҪ“з§ҜзӣёеҗҢзҡ„жә¶ж¶Ів‘ гҖҒв‘ЎгҖҒв‘ўеҲҶеҲ«дёҺи¶ійҮҸй“қзІүеҸҚеә”пјҢз”ҹжҲҗH2зҡ„йҮҸпјҡв‘ жңҖе°‘ В В CпјҺе°ҶзӯүдҪ“з§Ҝзҡ„еӣӣз§Қжә¶ж¶ІеҲҶеҲ«зЁҖйҮҠ100еҖҚпјҢжүҖеҫ—жә¶ж¶Ізҡ„pHпјҡв‘ўпјһв‘Јпјһв‘Ўпјһв‘ В В DпјҺеёёжё©дёӢпјҢе°Ҷв‘Ўе’Ңв‘ўзӯүдҪ“з§Ҝж··еҗҲпјҡc(CH3COOпјҚ)-c(Na+)=c(HпјӢ)-c(OHпјҚ)
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘеңЁ25в„ғж—¶пјҢKspпјҲAgClпјү=1.8Г—10п№Ј10пјҢKspпјҲAgIпјү=8.3Г—10п№Ј17пјҢдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ В AпјҺеңЁ100mL0.01mol/LKClжә¶ж¶ІдёӯпјҢеҠ е…Ҙ1mL В BпјҺеҫҖж°ҜеҢ–银зҡ„жӮ¬жөҠж¶ІдёӯеҠ зЎқ酸银пјҢcпјҲClп№ЈпјүгҖҒcпјҲAg+пјүеқҮеҮҸе°Ҹ В CпјҺз”ұдәҺKspпјҲAgClпјүпјһKspпјҲAgIпјүпјҢAgCl жІүж·ҖеңЁдёҖе®ҡжқЎд»¶дёӢеҸҜиҪ¬еҢ–дёәAgIжІүж·Җ В DпјҺеҗ‘AgClжІүж·Җзҡ„жә¶и§Је№іиЎЎдҪ“зі»дёӯеҠ е…ҘNaClеӣәдҪ“пјҢAgClзҡ„жә¶и§ЈеәҰеҮҸе°Ҹ
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
В жҹҗеҺҹз”өжұ жҖ»еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҡ2Fe3++Fe=3Fe2+пјҢдёҚиғҪе®һзҺ°иҜҘеҸҚеә”зҡ„еҺҹз”өжұ жҳҜ В AпјҺжӯЈжһҒдёәCuпјҢиҙҹжһҒдёәFeпјҢз”өи§ЈиҙЁдёәFeCl3жә¶ж¶І В BпјҺжӯЈжһҒдёәCпјҢиҙҹжһҒдёәFeпјҢз”өи§ЈиҙЁдёәFeпјҲNO3пјү2жә¶ж¶І В CпјҺжӯЈжһҒдёәAgпјҢиҙҹжһҒдёәFeпјҢз”өи§ЈиҙЁдёәFe2пјҲSO4пјү3жә¶ж¶І В DпјҺжӯЈжһҒдёәPtпјҢиҙҹжһҒдёәFeпјҢз”өи§ЈиҙЁдёәFe2пјҲSO4 пјү3жә¶ж¶І
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүдёҖз§Қ银й”Ңз”өжұ пјҢе…¶з”өжһҒеҲҶеҲ«дёәAg20е’ҢZnOпјҢз”өи§ЈиҙЁжә¶ж¶ІдёәKOHгҖҒз”өжһҒеҸҚеә”ејҸеҲҶеҲ«дёәпјҡ В В Zn+2OH-- 2e-=ZnO+H2O,В В В В Ag2 В A.ZnжҳҜжӯЈжһҒпјҢAg2OжҳҜиҙҹжһҒВ В В В В В В В В CпјҺдҪҝз”ЁдёӯпјҢз”өжһҒиҙҹжһҒеҢәжә¶ж¶Ізҡ„pHеҮҸе°ҸВ DпјҺZnжһҒеҸ‘з”ҹиҝҳеҺҹеҸҚеә”пјҢAg2OжһҒеҸ‘з”ҹж°§еҢ–еҸҚеә”
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
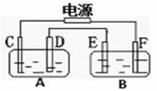
еҰӮеӣҫпјҢAжұ з”ЁзҹіеўЁз”өжһҒз”өи§ЈNaOHжә¶ж¶ІпјҢBжұ зІҫзӮјзІ—й“ңпјҢдёҖж®өж—¶й—ҙеҗҺеҒңжӯўйҖҡз”өпјҢAжұ дёӯDжһҒдә§з”ҹе…·жңүж°§еҢ–жҖ§зҡ„ж°”дҪ“еңЁж ҮеҮҶзҠ¶еҶөдёӢдёә2.24LпјҺдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
В BпјҺ DгҖҒEдёӨжһҒйғҪеҸ‘з”ҹж°§еҢ–еҸҚеә” В CпјҺ FжһҒеә”дёәзәҜй“ңжқҝжқҗж–ҷ В В В В В В В В В В DпјҺ Bжұ дёӯEжһҒиҙЁйҮҸеўһеҠ 12.8g
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
зҮғж–ҷз”өжұ жҳҜеҲ©з”ЁзҮғж–ҷпјҲеҰӮH2гҖҒCOгҖҒCH4зӯүпјүдёҺж°§ж°”еҸҚеә”пјҢд»ҺиҖҢе°ҶеҢ–еӯҰиғҪиҪ¬еҢ–жҲҗз”өиғҪзҡ„иЈ…зҪ®пјҺдёӢеҲ—е…ідәҺз”Ізғ·зҮғж–ҷз”өжұ пјҲNaOHжә¶ж¶ІдҪңз”өи§ЈиҙЁпјүзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ В A. В BпјҺиҙҹжһҒеҸҚеә”дёәпјҡCH4+10OHп№Јп№Ј8eп№Ј=CO32п№Ј+7H2O В CпјҺж”ҫз”өж—¶пјҢеӨ–з”өи·Ҝдёӯз”өеӯҗд»ҺжӯЈжһҒжөҒеҗ‘иҙҹжһҒВ В В DпјҺйҡҸзқҖж”ҫз”өзҡ„иҝӣиЎҢпјҢжә¶ж¶Ізҡ„pHдҝқжҢҒдёҚеҸҳ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢпјҢеңЁдёӢеҲ—жә¶ж¶ІдёӯеҸҜиғҪеӨ§йҮҸе…ұеӯҳзҡ„зҰ»еӯҗз»„жҳҜ В AпјҺpH=0зҡ„жә¶ж¶ІпјҡFe2+гҖҒMg2+гҖҒNO3п№ЈгҖҒSO42п№Ј В BпјҺз”ұж°ҙз”өзҰ»еҮәзҡ„cпјҲH+пјү=1Г—10п№Ј13mol/Lзҡ„жә¶ж¶ІпјҡAl3+гҖҒK+гҖҒSO42п№ЈгҖҒClп№Ј В CпјҺc(OHпјҚ) /c(HпјӢ)=1012зҡ„жә¶ж¶ІдёӯпјҡNH4+гҖҒAl3+гҖҒNO3п№ЈгҖҒCO32п№Ј В DпјҺpH=14зҡ„жә¶ж¶ІпјҡNa+гҖҒK+гҖҒAl3+гҖҒCO32п№Ј
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёӯй”ҷиҜҜзҡ„жҳҜпјҡ В В в‘ еҢ–еӯҰжҖ§иҙЁзӣёдјјзҡ„жңүжңәзү©жҳҜеҗҢзі»зү© В В в‘ЎеҲҶеӯҗз»„жҲҗзӣёе·®дёҖдёӘжҲ–еҮ дёӘCH2еҺҹеӯҗеӣўзҡ„жңүжңәзү©жҳҜеҗҢзі»зү© В В в‘ўиӢҘзғғдёӯзўіпјҺж°ўе…ғзҙ зҡ„иҙЁйҮҸеҲҶж•°зӣёеҗҢпјҢе®ғ们еҝ…е®ҡжҳҜеҗҢзі»зү© В В в‘Јдә’дёәеҗҢеҲҶејӮжһ„дҪ“зҡ„дёӨз§Қжңүжңәзү©зҡ„зү©зҗҶжҖ§иҙЁжңүе·®еҲ«пјҢдҪҶеҢ–еӯҰжҖ§иҙЁеҝ…е®ҡзӣёдјјпјҺ В В AпјҺв‘ в‘Ўв‘ўв‘ЈВ В В В В В BпјҺеҸӘжңүв‘Ўв‘ўВ В В В В В CпјҺеҸӘжңүв‘ўв‘ЈВ В В В В DпјҺеҸӘжңүв‘ в‘Ўв‘ў
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗзғғзҡ„з»„жҲҗдёӯеҗ«зўігҖҒж°ўе…ғзҙ зҡ„иҙЁйҮҸжҜ”дёә6пјҡ1пјҢиҜҘзғғеҜ№ж°®ж°”зҡ„зӣёеҜ№еҜҶеәҰдёә2пјҲеңЁзӣёеҗҢжқЎд»¶дёӢжөӢе®ҡпјүпјҢ иҜҘзғғиғҪдёҺH2еҸ‘з”ҹеҠ жҲҗеҸҚеә”пјҢжүҖеҫ—еҠ ж°ўдә§зү©зҡ„дәҢж°Ҝд»Јзү©жңүдёүз§ҚеҗҢеҲҶејӮжһ„дҪ“пјҢеҲҷиҜҘзғғдёә В В AпјҺCH2=CHп№ЈCH2п№ЈCH3 В В В BпјҺCH2=CH2В В В В В В В В CпјҺCH3п№ЈCH=CHп№ЈCH3В В DпјҺCH3п№ЈCпјҲCH3пјү=CH2В В
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
В з”ЁзҹіеўЁз”өжһҒз”өи§Ј100mL H2SO4дёҺCuSO4зҡ„ж··еҗҲжә¶ж¶ІпјҢйҖҡз”өдёҖж®өж—¶й—ҙеҗҺпјҢдёӨжһҒеқҮ收йӣҶ В В AпјҺ1molвҖўLп№Ј1В В В В В В BпјҺ2 molвҖўLп№Ј1В В В CпјҺ3 molвҖўLп№Ј1 В В В В В DпјҺ4 molвҖўLп№Ј1
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
зҺ°жңү0.4molвҖўLп№Ј1 HAжә¶ж¶Іе’Ң0. AпјҺиӢҘHAз”өзҰ»иғҪеҠӣеӨ§дәҺAвҖ”ж°ҙи§ЈиғҪеҠӣпјҢеҲҷcпјҲNa+пјүпјһcпјҲAпјүпјһcпјҲHAпјүпјһcпјҲH+пјүпјһcпјҲOHп№Јпјү BпјҺиӢҘAп№Јж°ҙи§ЈиғҪеҠӣеӨ§дәҺHAз”өзҰ»иғҪеҠӣпјҢеҲҷжңүcпјҲAп№ЈпјүпјһcпјҲHAпјүпјһпјҲNa+пјүпјһcпјҲOHп№ЈпјүпјһcпјҲH+пјү CпјҺж— и®әиҜҘжә¶ж¶Іе‘Ҳй…ёжҖ§иҝҳжҳҜзўұжҖ§пјҢйғҪжңүcпјҲNa+пјү+cпјҲH+пјү=cпјҲAп№Јпјү+cпјҲOHп№Јпјү DпјҺж— и®әиҜҘжә¶ж¶Іе‘Ҳй…ёжҖ§иҝҳжҳҜзўұжҖ§пјҢйғҪжңүcпјҲNa+пјү=cпјҲAп№Јпјү+cпјҲHAпјү
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗж··еҗҲж°”дҪ“з”ұдёӨз§Қж°”жҖҒзғғз»„жҲҗпјҺ2.24LиҜҘж··еҗҲж°”дҪ“е®Ңе…ЁзҮғзғ§еҗҺпјҢеҫ—еҲ°4.48LдәҢж°§еҢ–зўіпјҲж°”дҪ“е·ІжҠҳз®—жҲҗж ҮеҮҶзҠ¶еҶөпјүе’Ң3.6gж°ҙпјҺеҲҷиҝҷдёӨз§Қж°”дҪ“еҸҜиғҪжҳҜ В В AпјҺCH4е’ҢC3H8В В В В В В В BпјҺCH4е’ҢC3H4В В В В В В CпјҺC2H4е’ҢC3H4В В В В DпјҺC2H4е’ҢC2H6
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
В дёҚз®Ўд»ҘдҪ•з§ҚжҜ”дҫӢж··еҗҲпјҢеҸӘиҰҒжҖ»иҙЁйҮҸдёҖе®ҡпјҢе……еҲҶзҮғзғ§еҗҺз”ҹжҲҗзҡ„дәҢж°§еҢ–зўізҡ„йҮҸдёҚеҸҳзҡ„жҳҜ В В AпјҺд№ҷзғҜпјҲC2H4пјүе’ҢиӢҜпјҲC6H6пјүВ В В В В В BпјҺд№ҷйҶҮе’ҢдёҷйҶҮпјҲCH3CH2CH2OHпјү В В CпјҺд№ҷйҶҮе’Ңд№ҷйҶҡпјҲC2H5OC2H5пјү В В В В В В В DпјҺз”ІйҶӣпјҲ HCHOпјүе’Ңд№ҷй…ёВ В В В В В В В В В В В В В В В В В В В В В В В
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
жңүд»ҘдёӢеҗ„з»„зү©иҙЁпјҢе®ҢжҲҗд»ҘдёӢеҗ„з»„й—®йўҳпјҡ AпјҺж°§ж°”дёҺиҮӯж°§В В В В В В В BпјҺж°•дёҺж°ҳВ В В В В В В В В CпјҺ DпјҺд№ҷзғҜдёҺ1-дёҒзғҜВ В В В В В В В В В В В В EпјҺе·ұзғ·дёҺ2,3-дәҢз”ІеҹәдёҒзғ· (1)д»ҘдёҠеҗ„з»„зү©иҙЁеұһдәҺеҗҢзі»зү©зҡ„жҳҜВ В В В В В В В В В пјӣеұһдәҺеҗҢеҲҶејӮжһ„дҪ“зҡ„жҳҜВ В В В В В В В В В В пјӣ В В В В еұһдәҺеҗҢдҪҚзҙ зҡ„жҳҜВ В В В В В В В В В В В В В гҖӮ (2)2,3-дәҢз”ІеҹәдёҒзғ·з”ұжҹҗзғҜзғғеҠ жҲҗеҫ—еҲ°пјҢеҲҷиҜҘзғҜзғғзҡ„з»“жһ„з®ҖејҸеҸҜиғҪдёә В В В В В В В В В В В В В В В В В В В В В В В В В В гҖҒВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||
|
еёёжё©пјҢе°ҶжҹҗдёҖе…ғй…ёHAе’ҢNaOHжә¶ж¶ІзӯүдҪ“з§Ҝж··еҗҲпјҢдёӨз§Қжә¶ж¶Ізҡ„жө“еәҰе’Ңж··еҗҲеҗҺжүҖеҫ—жә¶ж¶Ізҡ„pHеҰӮдёӢпјҡ
(1)д»Һв‘ з»„жғ…еҶөеҲҶжһҗпјҢHAжҳҜејәй…ёиҝҳжҳҜејұй…ёпјҹВ В В В В В В В В В В В В В (3)д»Һв‘ўз»„е®һйӘҢз»“жһңеҲҶжһҗпјҢиҜҙжҳҺHAзҡ„з”өзҰ»зЁӢеәҰВ В В В В В В В В В В В В NaAзҡ„ж°ҙи§ЈзЁӢеәҰпјҢиҜҘж··еҗҲжә¶ж¶ІдёӯзҰ»еӯҗжө“еәҰз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜпјҡ____________________________________гҖӮ
|
|||||||||||||||||
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
IпјҺж°ҙзҡ„з”өзҰ»е№іиЎЎжӣІзәҝеҰӮеӣҫжүҖзӨәпјҢж №жҚ®еӣҫдёӯж•°жҚ®пјҢеӣһзӯ”й—®йўҳпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В
пјҲ1пјүеӣҫдёӯAгҖҒBгҖҒCгҖҒDеӣӣзӮ№зҡ„KW з”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҺ пјҲ2пјүеңЁ100в„ғж—¶пјҢе°ҶpH=2зҡ„зЎ«й…ёдёҺpH=12зҡ„KOHжә¶ж¶Іж··еҗҲиҮіе‘ҲдёӯжҖ§пјҢйңҖзЎ«й…ёе’Ңж°ўж°§еҢ–й’ҫзҡ„дҪ“з§ҜжҜ”дёә В В В В В В В В В В В В В В пјҺ в…ЎпјҺпјҲ1пјүе®Өжё©дёӢпјҢеҗ‘ж°Ёж°ҙдёӯеҠ е…ҘзЁҖзӣҗй…ёпјҢдҪҝе…¶жҒ°еҘҪдёӯе’ҢпјҢз”ЁзҰ»еӯҗж–№зЁӢејҸиЎЁзӨәжә¶ж¶ІдёҚе‘ҲдёӯжҖ§зҡ„еҺҹеӣ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҢжүҖеҫ—жә¶ж¶Ідёӯеҗ„зҰ»еӯҗзү©иҙЁзҡ„йҮҸжө“еәҰз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В . пјҲ2пјүж°Ёж°ҙдёӯеҠ е…Ҙе°‘йҮҸж°Ҝ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
В В В д№ҷдәҢй…ёпјҲHOOCп№ЈCOOHпјҢеҸҜз®ҖеҶҷдёәH2C2O4пјүдҝ—з§°иҚүй…ёгҖӮ пјҲ1пјүжҺўз©¶иҚүй…ёзҡ„й…ёжҖ§в‘ е·ІзҹҘпјҡ25в„ғж—¶пјҢH2C2O4 зҡ„з”өзҰ»еёёж•° K1=5.4Г—10-2пјҢK2=5.4Г—10-5пјӣ H2CO3зҡ„з”өзҰ»еёёж•° K1=4.5Г—10-7пјҢВ K2=4.7Г—10-11еҲҷдёӢеҲ—еҢ–еӯҰж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜгҖҖ гҖҖВ В В В В пјҲеЎ«йҖүйЎ№еәҸеҸ·пјҢдёӢеҗҢпјү В AпјҺH2C2O4+CO32-пҖӯ=HCO3-пҖӯ+HC2O4-пҖӯВ В В В В В В В BпјҺHC2O4-пҖӯ+CO32-пҖӯ=HCO3-пҖӯ+C2O42-пҖӯ В CпјҺH2O+CO2+C2O42-пҖӯ=HC2O4-пҖӯ+HCO3-пҖӯВ В В В DпјҺC2O42-пҖӯ+CO2+H2O=H2C2O4+CO32-пҖӯ в‘Ўеҗ‘1L 0.02mol/L H2C2O4жә¶ж¶Ідёӯж»ҙеҠ 1L 0.01mol/L NaOHжә¶ж¶ІпјҺж··еҗҲжә¶ж¶Ідёӯ В cпјҲH+пјүпјһcпјҲOHп№ЈпјүпјҢдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜгҖҖ гҖҖВ В В В пјҺ В AпјҺcпјҲH2C2O4пјүпјһcпјҲHC2O4-пҖӯпјү В BпјҺcпјҲOHп№Јпјү=cпјҲH+пјү+2cпјҲH2C2O4пјү+cпјҲHC2O4-пҖӯпјү В CпјҺcпјҲNa+пјү+cпјҲH+пјү=2cпјҲC2O42-пҖӯпјү+cпјҲHC2O4-пҖӯпјү+cпјҲOHп№Јпјү В DпјҺcпјҲH2C2O4пјү+cпјҲC2O42-пҖӯпјү+cпјҲHC2O4-пҖӯпјү=0.02mol/L пјҲ2пјүз”Ёй…ёжҖ§KMnO4жә¶ж¶Іж»ҙе®ҡеҗ«жқӮиҙЁзҡ„Na2C2O4ж ·е“ҒпјҲжқӮиҙЁдёҚдёҺKMnO4е’ҢH2SO4жә¶ж¶ІеҸҚеә”пјүпјҺ е®һйӘҢжӯҘйӘӨпјҡ еҮҶзЎ®з§°еҸ–1gж ·е“ҒNa2C в‘ й«ҳй”°й…ёй’ҫжә¶ж¶Іеә”иЈ…еңЁгҖҖ гҖҖВ В В В В В В В В В В ж»ҙе®ҡз®ЎдёӯпјҺпјҲеЎ«вҖңй…ёејҸвҖқжҲ–вҖңзўұејҸвҖқпјү в‘ЎдёӢеҲ—ж“ҚдҪңеҸҜиғҪдҪҝжөӢйҮҸз»“жһңеҒҸй«ҳзҡ„жҳҜгҖҖ гҖҖВ В В В В В В В В пјӣ AпјҺзӣӣиЈ…Na2C2O4зҡ„ж»ҙе®ҡз®ЎжІЎж¶Ұжҙ—В В BпјҺзӣӣиЈ…й«ҳй”°й…ёй’ҫжә¶ж¶Ізҡ„ж»ҙе®ҡ CпјҺиҜ»ж•°ж—¶ж»ҙе®ҡеүҚд»°и§ҶпјҢж»ҙе®ҡеҗҺдҝҜи§ҶВ В В В DпјҺй”ҘеҪўз“¶дёӯж®Ӣз•ҷе°‘йҮҸж°ҙ в‘ўи®Ўз®—ж ·е“ҒдёӯNa2C2O4зҡ„зәҜеәҰгҖҖ гҖҖВ В В В В В В В В В В В В В пјҺ
|
|
- 2019е№ҙиҮі2020е№ҙй«ҳдәҢдёҠеҶҢејҖеӯҰиҖғиҜ•еҢ–еӯҰиҜ•еҚ·пјҲдә‘еҚ—зңҒеҜҢе®ҒеҺҝдёҖдёӯпјү
- зҰҸе»әзңҒиҺҶ田第дёҖдёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠеҶҢжңҹдёӯиҖғиҜ•еҢ–еӯҰйўҳеҗҢжӯҘи®ӯз»ғе…Қиҙ№иҜ•еҚ·
- 2017-2018е№ҙй«ҳдёҖеҢ–еӯҰ第дёҖеӯҰжңҹзү©иҙЁз»“жһ„з»јеҗҲжөӢиҖғйўҳпјҲдёҠжө·еёӮпјү
- йІҒ科зүҲйҖүжӢ©жҖ§еҝ…дҝ®1第2з« еҢ–еӯҰеҸҚеә”зҡ„ж–№еҗ‘гҖҒйҷҗеәҰдёҺйҖҹзҺҮ 第2иҠӮ еҢ–еӯҰеҸҚеә”зҡ„йҷҗеәҰ иҜҫж—¶2 еҸҚеә”жқЎд»¶еҜ№еҢ–еӯҰе№іиЎЎзҡ„еҪұе“Қ
- 2018иҮі2019е№ҙй«ҳдәҢ第дәҢеӯҰжңҹ3жңҲжңҲиҖғеҢ–еӯҰиҖғиҜ•е®Ңж•ҙзүҲпјҲзҰҸе»әзңҒеҺҰй—ЁеёӮ第дёҖдёӯеӯҰпјү
- жҳҶжҳҺеёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- жӯҰжұүеёӮ2020е№ҙй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҹдёӯиҖғиҜ•е…Қиҙ№иҜ•еҚ·
- дёҪж°ҙеёӮ2020е№ҙй«ҳдәҢдёӢеҚҠжңҹеҢ–еӯҰжңҹжң«иҖғиҜ•иҜ•еҚ·еёҰи§ЈжһҗеҸҠзӯ”жЎҲ