2019福建高二上学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
下列说法正确的是( ) A.“煮豆燃豆萁,豆在釜中泣”诗中涉及的能量变化主要是化学能转化为热能和光能 B.已知4P(红磷,s)== P4(白磷,s)△H=+17 kJ/mol ,则白磷比红磷更稳定 C.同温同压下,H2(g)+Cl2(g) == 2HCl(g)在光照和点燃条件下的ΔH不同 D.已知 H+(aq) + OH-(aq) === H2O(aq) △H= —57.3kJ/mol ,则1molH2SO4与1mol Ba(OH)2的反应热△H=2×(—57.3) kJ/mol
|
|
| 2. | 详细信息 |
|
下列关于化学能转化为电能的四种装置的说法正确的是( )
A.电池Ⅰ工作时,电子由锌经过电解质溶液流向铜 B.电池Ⅱ是一次电池 C.电池Ⅲ工作时,氢气发生还原反应 D.电池Ⅳ工作一段时间后,锌筒变软
|
|
| 3. | 详细信息 |
|
在2A(g)+B(g) A.v(A)=0.5 mol·L-1·min-1 B.v(B)=0.003 mol·L-1·s-1 C.v (C)=0.8 mol·L-1·min-1 D.v(D)=0.01 mol·L-1·s-1
|
|
| 4. | 详细信息 |
|
下列叙述正确的是( ) A.在镀件上电镀锌,用锌作阴极 B.将水库中的水闸(钢板)与直流电源的负极相连接,可防止水闸被腐蚀 C.电解熔融的氧化铝制取金属铝,用铁作阳极 D.铜板上的铁铆钉在潮湿的空气中直接发生反应:Fe —3e- = Fe3+,继而形成铁锈
|
|
| 5. | 详细信息 |
|
下列实验操作正确的是( ) A.用酚酞试纸测定氨的酸碱性时,试纸需用蒸馏水润湿 B.测定中和热的实验中,酸或碱不可过量,否则会产生较大误差 C.中和热测定实验中可以用环形铁丝搅拌棒代替环形玻璃搅拌棒 D.用pH试纸测定pH时,将溶液倒在试纸上,观察颜色变化并与标准比色卡对照
|
|
| 6. | 详细信息 |
|
常温下,关于pH=2的盐酸,下列说法不正确的是( ) A.溶液中c(H+)=1.0×10-2 mol·L-1 B.加水稀释100倍后,溶液的pH=4 C.此溶液中由水电离出的H+和OH-浓度均为1.0×10-12 mol·L-1 D.加入等体积pH=12的Ba(OH)2溶液,溶液呈碱性
|
|
| 7. | 详细信息 |
|
在一个不传热的固定容积的密闭容器中,发生可逆反应mA(g)+nB(g) 当m、n、p、q为任意整数时,反应达到平衡的标志是( ) ①体系的压强不再改变 ②体系的温度不再改变 ③体系的密度不再改变 ④各组分质量分数不再改变 A. ①②③ B.②③④ C.①②④ D.①③④
|
|
| 8. | 详细信息 |
|
下列说法正确的是( ) A.强电解质的水溶液导电性不一定强于弱电解质的水溶液 B.可溶性盐在水中完全电离是强电解质,难溶性盐在水中溶解度很小是弱电解质 C.硫酸氢钠在水溶液和熔融状态下的电离方程式均为:NaHSO4 = Na+ + H+ + SO42- D.强电解质都是离子化合物,在水溶液或熔融状态下完全电离,以离子形式存在
|
|
| 9. | 详细信息 |
|
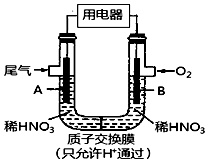
某学习小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法正确的是( )
A.该电池工作时,电子的流向为:外电路由B到A,内电路由A到B形成闭合回路 B.电极B附近的HNO3浓度增大 C.A电极的反应为:NO2-e-+H2O=NO3-+2H+ ;NO-3e-+2H2O=NO3-+4H+ D.该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和1molNO2的混合尾气
|
|
| 10. | 详细信息 |
|
把0.05 mol NaOH固体分别加入到100 mL浓度均为0.5 mol/L的下列溶液中,导电 能力变化较大的是( ) A.MgSO4溶液 B.盐酸 C.CH3COOH D. NH4Cl溶液
|
|
| 11. | 详细信息 | |||
|
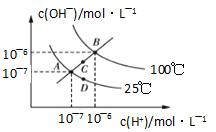
纯水中存在的平衡:H2O 不正确的是( )
A.A、C两点可能为纯水 B.若从A点到C点,可采用:升高温度,在水中加入少量氯化钠固体 C.若从C点到D点,可采用:降低温度,在水中加入少量硫酸氢钠固体 D.若从A点到D点,可采用:温度不变,在水中加入少量碱
|
||||
| 12. | 详细信息 |
|
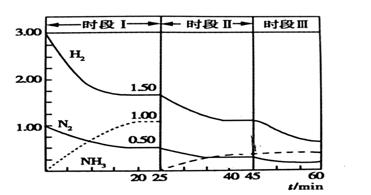
工业合成氨反应:N2(g)+3H2(g)
A.25min时采取的措施是降低温度或增大压强 B.将0.5 mol氮气、1.5 mol氢气置于1 L密闭容器中发生反应,放出的热量为46 kJ C.Ⅰ、Ⅱ、Ⅲ 三个时间段分别是改变一个条件引起的平衡移动,平衡时平衡常数: KⅢ > KⅠ = KⅡ D.为了增大合成氨的产率可以通过使用催化剂、原料的循环使用来实现
|
|
| 13. | 详细信息 |
|
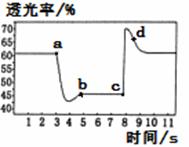
已知反应:2NO2(红棕色)
越深,透光率越小)。下列说法不正确的是( ) A.b点达到平衡状态 B.b点与a点相比,c(NO2)、c(N2O4)均减小 C.d点:v(正)<v(逆) D.若在c点将温度降低,其透光率将增大
|
|
| 14. | 详细信息 | |||||||||||
|
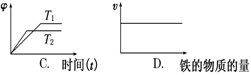
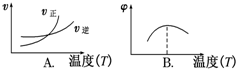
下列图像不符合反应Fe(s)+H2O(g) (图中v是速率,φ为混合物中H2的体积百分含量)
|
||||||||||||
| 15. | 详细信息 | |||||||||
|
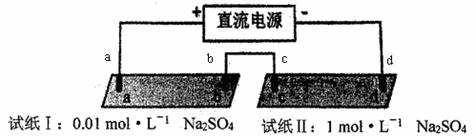
探究电场作用下阴阳离子的迁移。a、b、c、d 均为石墨电极,电极间距4cm。将pH试纸用不同浓度Na2SO4溶液充分润湿,进行如下实验,下列说法不正确的是( )
实验现象:
A.Na2SO4溶液中SO42-向a极和c极移动 B.a极附近试纸变红的原因是:2H2O+2e-= H2↑+2OH- C.试纸I的现象说明,此环境中H+的迁移速率比OH-快 D.对比试纸I和试纸II的现象,说明电解质浓度环境影响H+和OH-的迁移
|
||||||||||
| 16. | 详细信息 | ||||||||||||
|
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)
A.体系平衡时与反应起始时的压强之比为5∶6 B.反应在前50 s 的平均速率ν(PCl3)= 0. 0032 mol·L-1·s-1 C.相同温度下,起始时向容器中充入0.6mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2,反应达到平衡前ν(正)>ν(逆) D.相同温度下,若起始时向容器中充入2. 0 mol PCl3 和2. 0 mol Cl2,达到平衡时,PCl3 的质量分数比上述平衡体系小
|
|||||||||||||
| 17. | 详细信息 |
|
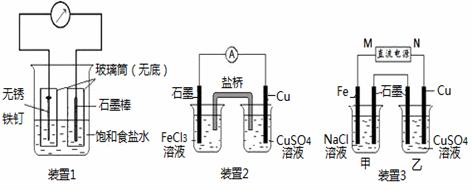
如图所示3套实验装置,分别回答下列问题。
棒附近的溶液变红,该电极反应式为 。 (2)装置2中左池为氯化铁溶液,右池为硫酸铜溶液,一段时间后右池溶液中c(Cu2+) (填“增大”、“减小”或“不变”),若该装置的盐桥中盛装的是NH4NO3的琼脂 溶液,则盐桥中的 离子(填“NH4+”或“NO3-”)向氯化铁溶液迁移。 (3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液。反应一段时间后,观察到乙烧杯的石墨电极上有气泡生成。 ①电源的M端为 极;甲烧杯中铁电极的电极反应式为 。 ②乙烧杯中电解反应的离子方程式为 。 ③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.32g,甲烧杯中产生的气体标准状况下体积为 mL;电解后乙烧杯溶液的pH为 (假设电解前后溶液的体积不变)。 ④若要将乙池设计成电解精炼铜的装置,则乙池的石墨应改成 (填“粗铜”或“精铜”)。
|
|
| 18. | 详细信息 | |||||||||||||||||||||||||||||
|
能源、环境与生产生活和社会发展密切相关。 (1)工业上利用CO和H2在催化剂作用下合成甲醇:CO(g)+2H2(g)
则 CO(g)+2H2(g)
B极为电池______极,B极的电极反应式为_________________________________。 (3)参考合成反应CO(g)+2H2(g)
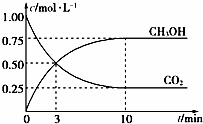
①该反应正反应是 (填“放热”或“吸热”)反应; ②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T= ℃。 (4)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)
①该反应的平衡常数表达式为K=_____________________; 从反应开始到10min,v(H2)=______________________mol/(L·min); ②下列情况能说明该反应一定达到平衡状态的是___________(填字母) A.v(CO2)消耗 = v(CH3OH)生成 B.气体的密度不再随时间改变 C.CO2和CH3OH的浓度之比不再随时间改变 D.气体的平均相对分子质量不再随时间改变 ③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有___________ (填字母) A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂 ④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度____________(填“>”、“ <”或“=”)0.25mol/L。
|
||||||||||||||||||||||||||||||
| 19. | 详细信息 | ||||||||||||||||||||||||||||
|
研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:
已知:Cr2O72-(橙色)+H2O (1)试管c和b对比,推测试管c的现象是____________________________________。 (2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?________(“是”或“否”),理由是___________ _____________________________________________________________________。 (3)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是____________________________________________________________________。 (4)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如下表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
①对比实验ⅰ和实验ⅱ可知,___________(“升高”或“降低”)pH可以提高Cr2O72-的去除率。 ②实验ⅱ中Cr2O72-放电的电极反应式为______________________________________。 ③实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因是__________________________________________________
|
|||||||||||||||||||||||||||||
| 20. | 详细信息 |
|
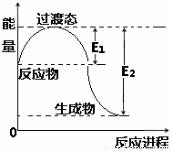
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。 (1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下: 6FeO(s) + CO2(g) = 2Fe3O4(s) + C(s) △H= —76.0kJ/mol C(s) + 2H2O(g) = CO2(g) + 2H2(g) △H= + 113.4kJ/mol 写出FeO(s)和H2O(g)生成Fe3O4(s)和H2(g)的热化学方程式____________________。 (2)右图为1 mol NO2(g)和1 mol CO(g)反应生成NO(g)和CO2(g)过程中的能量变化示
若在反应体系中加入催化剂,反应速率增大,则E1、ΔH的变化分别是________、 ________(填“增大”、“减小”或“不变”);该反应放出的热量为 kJ。 (3)若反应SO2(g)+I2(g)+2H2O(g) ═ H2SO4(l)+2HI(g)在150 ℃下能自发进行, 则ΔH 0 (填“大于”、“ 小于”或“大于或小于都可”)。
|
|