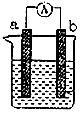2019浙江高一下学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
下列不属于化石燃料的是 A. 煤 B. 石油 C. 天然气 D. 甲醇
|
|
| 2. | 详细信息 |
|
人类将在未来几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能的转换形态),人们将适应“低碳经济”和“低碳生活”。下列说法不正确的是 A. 研究菠菜蛋白质“发电”不属于“太阳能文明” B. 发展太阳能经济有助于减缓温室效应 C. 太阳能电池可将太阳能转化为电能 D. 石油和天然气都属于碳素燃料
|
|
| 3. | 详细信息 |
|
.1993年的世界十大科技新闻称:中国学者许志福和美国科学家穆尔共同合成了世界上最大的碳氢分子,其中1个分子由1134个碳原子和1146个氢原子构成。关于此物质,下列说法错误的是 A. 是烃类化合物 B. 常温下呈固态 C. 具有类似金刚石的硬度 D. 易被氧化
|
|
| 4. | 详细信息 |
|
下列反应既是氧化还原反应,又是吸热反应的是 A. 铝片与稀硫酸反应 B. Ba(OH)2·8H2O与NH4Cl的反应 C. 甲烷在O2中的燃烧 D. 灼热的炭与CO2反应
|
|
| 5. | 详细信息 |
|
下列各组物质属于同分异构体的是 A. CH3CH2COOH和CH3COOCH3 B. O2和O3 C.
|
|
| 6. | 详细信息 |
|
下列与有机物结构、性质相关的叙述错误的是 A. 乙炔能使高锰酸钾溶液和溴水褪色,两者原理相同 B. 乙烯的空间构型是平面型 C. 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 D. 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有碳碳双键
|
|
| 7. | 详细信息 |
|
有关苯的结构和性质,下列说法正确的是 A. B. 苯在空气中不易燃烧完全,燃烧时冒浓烟 C. 酸性高锰酸钾溶液能与苯发生氧化反应而褪色 D. 向2 mL苯中加入1 mL酸性高锰酸钾溶液,震荡后静置,可观察到液体分层,上层呈紫红色
|
|
| 8. | 详细信息 |
|
下列反应不属于取代反应的是 A. CH4+Cl2 B. C. CH2=CH2+HBr D. CH3CH2OH+CH3COOH
|
|
| 9. | 详细信息 |
|
下列表示物质或微粒的化学用语或模型正确的是 A. 次氯酸分子结构式 H—Cl—O B. 钙离子的电子式:Ca2+ C. 二氧化碳电子式∶ D. Mg2+的结构示意图:
|
|
| 10. | 详细信息 |
|
对于A2+3B2 A. υ(B2)=0.8 mol/(L·s) B. υ(B2)= 3mol/(L·min) C. υ(C)=0.6 mol/(L·s) D. υ(A2)=0.4 mol/(L·s)
|
|
| 11. | 详细信息 |
|
下列化学键类型相同晶体类型也相同的是 A. 晶体SiO2与干冰 B. NaCl与HCl C. 金刚石和C60 D. NH4Cl与NaOH
|
|
| 12. | 详细信息 |
|
下列措施对增大反应速率明显有效的是 A. 在K2SO4与BaCl2两溶液反应时,增大压强 B. Fe与稀硫酸反应制取H2时,改用浓硫酸 C. Al在氧气中燃烧生成A12O3,将Al片改成Al粉 D. Na与水反应时增大水的用量
|
|
| 13. | 详细信息 |
|
下列叙述正确的是 A. 离子晶体中,只存在离子键,不可能存在其他化学键 B. 原子晶体中,只存在共价键;稀有气体的原子能形成分子晶体 C. NaHSO4、Na2O晶体中的阴、阳离子个数比均为1∶2 D. 阴、阳离子通过静电引力而形成的化学键叫离子键
|
|
| 14. | 详细信息 | ||||||||
|
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
由此可判断这四种金属的活动性顺序是 A. d>a>b>c B. b>c>d>a C. a>b>c>d D. a>b>d>c
|
|||||||||
| 15. | 详细信息 |
|
沼气是一种能源,它的主要成分是CH4。0.5mol CH4完全燃烧生成CO2和H2O(l),放出445kJ热量,则下列热化学方程式中正确的是 A. 2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)△H═+890 kJ/mol B. CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═+890 kJ/mol C. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═﹣890 kJ/mol D.
|
|
| 16. | 详细信息 |
|
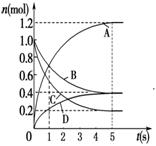
一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是
A. 该反应的化学方程式为6A+2 D B. 反应进行到1 s时,v(A)=v(B) C. 反应进行到5 s时,B的平均反应速率为0.06mol/(L·s) D. 反应进行到5 s时,v(A)=v(B)=v(C)=v(D)
|
|
| 17. | 详细信息 |
|
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是 A. 元素X 的简单气态氢化物的热稳定性比W的弱 B. 元素W 的最高价氧化物对应水化物的酸性比Z的弱 C. 原子半径的大小顺序: rY >rZ >rW >rX D. 化合物YX、ZX2、WX3 中化学键的类型相同
|
|
| 18. | 详细信息 |
|
已知钍 A. X的氢氧化物是一种强碱 B. X元素位于第六周期 C. X的碳酸盐难溶于水 D. X的最高化合价为+2价
|
|
| 19. | 详细信息 |
|
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是( ) A. 正极反应式:Ag+Cl--e-=AgCl B. 每生成1 mol Na2Mn5O10转移2 mol电子 C. Na+不断向“水”电池的负极移动 D. AgCl是还原产物
|
|
| 20. | 详细信息 |
|
1mol乙烯与Cl2完全加成,其产物再与Cl2彻底取代,两个过程中共用Cl2 A. 2mol B. 4mol C. 5mol D. 6mol
|
|
| 21. | 详细信息 |
|
等质量的两份锌粉a、b分别加入到两份相同体积相同、物质的量浓度相同且过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,下列各图为产生H2的体积V(L)与时间t(min)的关系,其中正确的是 A.
|
|
| 22. | 详细信息 |
|
在恒温恒容容器中:2NO2 ①单位时间内生成n mol O2的同时生成2n mol NO2; ②单位时间内生成n mol O2 的同时,生成2n mol NO; ③NO2、NO、O2 的反应速率的比为2 : 2 : 1的状态; ④混合气体的颜色不再改变的状态; ⑤混合气体的密度不再改变的状态;⑥混合气体的平均相对分子质量不再改变的状态。 A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
|
|
| 23. | 详细信息 |
|
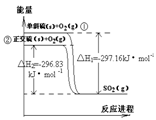
单斜硫和正交硫转化为二氧化硫 A. 单斜硫没有正交硫稳定 B. S(s,单斜)=S(s,正交) △H=+0.33 kJ· mol-1 C. 相同物质的量的正交硫比单斜硫所含能量高 D. ①式表示断裂l mol O2中
|
|
| 24. | 详细信息 |
|
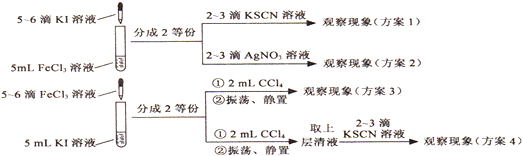
某同学为探究FeCl3与KI反应是否存在反应限度,设计了如下实验方案(FeC13溶液、KI溶液浓度均为0.1mo1・L-1),最合理的方案是
A. 方案1 B. 方案2 C. 方案3 D. 方案4
|
|
| 25. | 详细信息 | ||||||||||||||||||||||||||||
|
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2
分析实验数据所得出的结论不正确的是 A. 增大c(CH3COCH3),v(Br2)增大 B. 实验②和③的v(Br2)相等 C. 增大c(HCl),v(Br2)增大 D. 增大c(Br2),v(Br2)增大
|
|||||||||||||||||||||||||||||
| 26. | 详细信息 | ||||||||||
|
按要求书写 (1)氨气的电子式:_________,乙炔的结构简式:___________; (2)工业上利用乙烯催化水化法制取乙醇,化学反应方程式:________反应类型:____________ (3)苯与浓硝酸在50~60℃下发生硝化反应:________反应类型:_____________; (4)已知键能如下:
写出N2和H2合成NH3的热化学方程式:_____________。
|
|||||||||||
| 27. | 详细信息 |
|
将等物质 (1)x的值是__________; (2)B的平均反应速率__________; (3)则反应开始前放入容器中A的物质的量_____________。
|
|
| 28. | 详细信息 |
|
下图是某化学兴趣小组探究化学能转变为电能的装置。
(1)当电极a为Zn、电极b为Fe、电解质溶液为稀硫酸时,SO42-向_____极(填a或b)移动,正极的电极反应式为:_____________ (2)若依据氧化还原反应:Cu+2Fe3+=Cu2++2Fe2+设计原电池,电极a为石墨、则电极b为电池的_______极,发生的电极反应式为:_______,电极a上发生的电极反应为______(填“氧化”或“还原”)反应。 (3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用酸性溶液为电解液;则氢气应通入_____极(填a或b)。a极发生电极反应式为:________。当电路中通过2mol电子时,理论上消耗标况下氧气_____L。
|
|
| 29. | 详细信息 |
|
在①CH4、②C2H2、③C2H4、④C2H6、⑤苯中 (1)能使酸性高锰酸钾溶液褪色的是__________。(填序号,下同) (2)相同物质的量,在氧气中完全燃烧时消耗氧气最多的是________; (3)相同质量,在氧气中完全燃烧时消耗氧气最多的是____,耗氧量、生成CO2和水都相等的是___________。
|
|
| 30. | 详细信息 |
|
A、B、C、D、E为原子序数依次增大的短周期主族元素,A元素的一种单质是自然界最硬的物质,B为最活泼的非金属元素,C元素的原子的电子层数是最外层电子数的3倍,D元素最高化合价为+6价。 (1)D在周期表中的位置是 _____________,E的离子结构示意图_____________; (2)C与D 形成化合物的电子式为_____________; (3)A、D、E三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是______; (4)由B、C、D形成的简单离子半径由大到小的顺序是________________; (5)B形成的氢化物沸点比E形成的氢化物沸点_______(填“高”或“低”),原因是___________; (6)DBn做制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂.该物质的摩尔质量为146g/mol,该物质的化学式为____。已知DBn在温度高于45°时为气态,DBn属于____晶体。
|
|


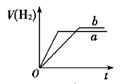 B.
B. 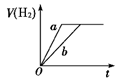 C.
C. 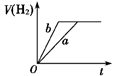 D.
D.