2018高一上学期人教版高中化学期中考试
| 1. | 详细信息 |
|
下列关于化学实验的说法中,符合实验安全要求的是( ) A. 制备氯气时严格检查装置的气密性,并设置尾气吸收装置 B. 用点燃的火柴在液化气钢瓶口检验是否漏气 C. 为防止药品污染,实验结束后,用剩的浓硝酸可倒入垃圾箱 D. 进入地下矿井中可用火把照明
|
|
| 2. | 详细信息 |
|
某实验小组只领取下列仪器或用品:冷凝管、牛角管、铁架台、铁圈、三角架、石棉网、烧杯、锥形瓶、普通漏斗、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、温度计、滤纸、火柴。只应用上述仪器或用品,不能进行的实验操作是( ) A. 蒸发 B. 过滤 C. 萃取 D. 蒸馏
|
|
| 3. | 详细信息 |
|
下列说法正确的是( ) A. CO2的摩尔质量为44g B. 标准状况下,2molNH3的气体摩尔体积为44.8L/mol C. H2O的摩尔质量和H2O的相对分子质量数值相等 D. 50mL 1mol/LNa2SO4 溶液中,Na+和SO42-物质的量之和是0.15mol
|
|
| 4. | 详细信息 |
|
下列实验设计中能达到预期目的的是( ) A. 用酒精萃取碘水中的碘,将碘的酒精溶液从分液漏斗的上口倒出 B. 在沸水中逐滴加入FeCl3溶液,继续煮沸至溶液呈红褐色即可得到Fe(OH)3胶体。 C. 将氢气和氧气的混合气体通过灼热的氧化铜除去氢气 D. 氯酸钾和二氧化锰的混合物充分加热后可用溶解、过滤、蒸发的方法分离
|
|
| 5. | 详细信息 |
|
下列各组物质按照单质、化合物、混合物顺序排列的是( ) A. 石墨 Fe(0H)3胶体 澄清石灰水 B. 氮气 干冰 冰水混合物 C. 液态氧 CuSO4·5H2O 浓硫酸 D. 硫粉 碘酒 含氧40%的氧化镁
|
|
| 6. | 详细信息 |
|
下列反应中,不属于氧化还原反应的是(反应条件未给出)( ) A. Fe2O3 + 3CO = 2Fe +3CO2 B. 4NH3 + 5O2 = 4NO + 6H2O C. 2HClO = 2HCl + O2↑ D. IBr+H2O==HIO+HBr
|
|
| 7. | 详细信息 |
|
下列说法正确的是( ) A. 在氧化还原反应中肯定有一种元素被氧化,另一种元素被还原 B. 化合反应和分解反应一定是氧化还原反应 C. 氧化还原反应一定有电子的转移 D. 离子反应可能是复分解反应,但离子反应一定不是氧化还原反应
|
|
| 8. | 详细信息 |
|
若用NA表示阿伏加德罗常数的数值,下列说法正确的是( ) A. 0.1 mol OH—所含电子数与1.7 g OH—所含质子数之差为NA B. 在0℃,101kPa时,22.4 L H2O中含有2NA个氢原子 C. 0.5 mol/L的BaCl2溶液中含Cl-个数为NA D. 标准状况下NA个CO2分子和11.2 L CH4的质量比为11:2
|
|
| 9. | 详细信息 |
|
同温同压下,由NO和CO组成的混合气体密度是H2的14.5倍,下列关系正确的是( ) A. 混合气体中,CO与NO质量比14:15 B. 混合气体中,CO与NO分子个数比1:2 C. 同温同压下,同体积的该混合气体与空气的质量不相等(空气平均相对分子质量为29) D. 同温同压下,该混合气体的密度与空气的密度不相等
|
|
| 10. | 详细信息 |
|
下列关于物质的量浓度表述正确的是( ) A. 98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L B. 当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1mol•L-1,只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1mol•L-1 C. 只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 D. 50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
|
|
| 11. | 详细信息 |
|
下列离子方程式,书写正确的一项是( ) A. 铁片插入硝酸银溶液中,有银析出: Fe+Ag+= Fe2++Ag B. 氢氧化钡溶液与硫酸铜溶液反应,有沉淀生成:Ba2++SO42-=BaSO4↓ C. 向Ca(OH)2溶液中通入过量的CO2:OH- + CO2 = HCO3— D. 向稀硫酸中加入Cu:Cu + 2H+ = Cu2+ + H2↑
|
|
| 12. | 详细信息 |
|
下列各组离子一定能大量共存的是( ) A. 在无色溶液中:Na+ Fe3+ Cl— SO42- B. 在含大量Fe3+ 的溶液中:NH4+ K+ NO3- OH- C. 在强碱溶液中:Na+ K+ NO3- CO32— D. 滴加紫色石蕊试剂显红的溶液中:K+ Fe2+ Cl— CO32—
|
|
| 13. | 详细信息 |
|
下列反应转化关系(未配平)肯定不正确的是( ) A. S+NaOH→Na2SO3+K2S+H2O B. FeO+HNO3→Fe(NO3)3+H2O C. Cu2O+H2SO4→CuSO4+Cu+H2O D. NH4NO3→N2+H2O
|
|
| 14. | 详细信息 |
|
下列反应中,电子转移方向和数目正确的是 ( )
A. A B. B C. C D. D
|
|
| 15. | 详细信息 |
|
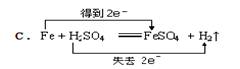
实验室中可用如下反应制取氯气:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应中下列说法中正确的是:( ) A. Mn元素被氧化 B. HCl全被还原 C. Mn失电子 D. 被氧化的HCl占全部HCl的5/8
|
|
| 16. | 详细信息 |
|
对于溶液中某些离子的检验及结论一定正确的是( ) A. 加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+ B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- C. 加入足量稀盐酸,无明显现象,再加入氯化钡溶液后有白色沉淀产生,一定有SO42- D. 加入稀盐酸产生无色气体,气体通入澄清石灰水,溶液变浑浊,一定有CO32—
|
|
| 17. | 详细信息 |
|
把400 mL含有BaCl2和KCl的混合溶液分成4等份,取一份加入含0.1mol Na2SO4的溶液,恰好使Ba2+完全沉淀;另取一份加入含0.4mol AgNO3的溶液,恰好使Cl-完全沉淀。则该混合溶液中钾离子浓度为( ) A. 0.02mol·L-1 B. 4mol·L-1 C. 3mol·L-1 D. 2mol·L-1
|
|
| 18. | 详细信息 |
|
下列关于胶体的叙述中,不正确的是( ) A. 粒子直径在1nm -- 100nm的物质为胶体 B. 用半透膜除去淀粉胶体中的NaCl溶液,用过滤能分离淀粉胶体中的泥沙 C. 利用丁达尔效应可以区分FeCl3溶液和Fe(0H)3胶体 D. 由于胶体粒子带有电荷,工厂中常用静电除去粉尘
|
|
| 19. | 详细信息 |
|
实验过程中,下列溶液的导电能力变化不大的是( ) A. Ba(OH)2溶液中滴入H2SO4溶液 B. 醋酸溶液中滴入氨水至过量 C. 澄清石灰水中通入CO2 D. NH4Cl溶液中加入适量的NaOH固体
|
|
| 20. | 详细信息 |
|
在CuO和Zn粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚锌片,发现锌片并无任何变化。根据上述现象,确定下面结论正确的是( ) A. 不溶物一定是Cu B. 不溶物一定含Cu,但不一定含Zn C. 不溶物一定是Zn D. 溶液中一定含有Zn2+,但不一定含有Cu2+
|
|
| 21. | 详细信息 |
|
现有下列十种物质:①冰醋酸(CH3COOH) ②铝 ③CaCO3 ④干冰 ⑤H2SO4 ⑥Ba(OH)2 ⑦氢氧化铁胶体 ⑧液态氨气 ⑨稀硝酸 ⑩KAl(SO4)2 (1)以上物质属于非电解质的是__________,在熔融态不导电而水溶液中导电的电解质是__________(填序号)。 (2)写出⑩在水溶液中的电离方程式_____________________________________ (3)上述物质中两种物质之间发生反应可用离子方程式表示为:H++OH- (4)用食醋除水垢原理实质就是①溶液与③反应,写出该反应的离子方程式 ______ (5)⑤的溶液和 (6)若⑨溶液中含有⑤,如果除去杂质⑤所选的试剂是:_____________,离子方程式:_________________________________________________ (7)将⑩和 (8)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,当有5.4g Al发生反应时,转移电子的数目为 ____________ 。
|
|
| 22. | 详细信息 |
|
已知氯化氢极易溶于水,标准状况下,1体积的水可以溶解500体积的氯化氢(HCl)气体,氯化氢的水溶液即为盐酸。 实验室现有质量分数为36.5%、密度为1.19g•cm﹣3的浓盐酸,若用该浓盐酸配制0.4mol•L﹣1的稀盐酸220mL,试回答下列问题: (1)配制该稀盐酸时,应选用的容量瓶的容积为(______). A. 100mL B. 220mL C. 250mL D. 500mL (2)计算需要____mL的浓盐酸, (3)在量取浓盐酸后,进行了下列操作: ①待稀释盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中. ②往容量瓶中加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切. ③在盛蒸馏水的烧杯中注入盐酸,并用玻璃棒搅动,使其混合均匀. ④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶. 上述操作中,正确的顺序是(填序号)_____________。 (4)在下述配制过程中,配制的稀盐酸浓度将会偏高的是_________________;使浓度会偏低的是 _________________________。(填序号) ①未转移溶液前容量瓶中有少量的蒸馏水 ②量取浓盐酸时俯视刻度线 ③量取浓盐酸后用蒸馏水洗涤量筒 ④若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶 ⑤定容时俯视刻度线 (5)在标准状况下,用一支收集满HCl气体的试管倒立在水槽中,水倒吸当充满试管时用塞子堵住试管口竖立(假设溶液不泄漏),则该溶液的溶质的物质的量浓度为_________________(保留两位小数)。
|
|
| 23. | 详细信息 |
|
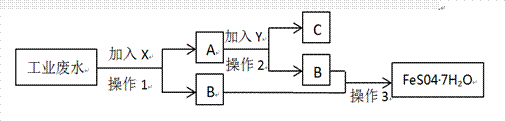
. 某工厂的工业废水中含有大量的FeSO4 、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:
物质X的化学式为________,操作1的名称:_________ 写出A中主要成分的化学式:_______________,在A中加入Y的离子方程式为:__________________________________________ 工业废水中加入X所发生的离子方程式为:__________________________________;是否氧化还原反应_______________(填“是”或“否”),如果是氧化还原反应,发生还原反应的是:______________(若非氧化还原反应不填) 操作中的操作3是:___________、冷却结晶、过滤、洗涤、烘干。
|
|
| 24. | 详细信息 | ||||||||||||||||||
|
用生石灰(CaO)、纯碱(Na2CO3)和食盐(NaCl)按一定比例混合可制得一种腌制原料,某同学为了探究该原料成份做了以下实验: 该同学取一定量的样品溶于水,主要发生的化学方程式有:____________________________, _____________________________________。 (2)该同学认为(1)过滤后所得的滤液中肯定含有大量的NaOH、NaCl溶质,还可能含有Ca(OH)2或Na2CO3 ,为了探究所得滤液中可能含有的物质是否存在,请你帮他完善实验方案。 实验方案设计如下表所示:
|
|||||||||||||||||||