2019河南高一下学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
下列说法中错误的是( ) A.原子及其离子的核外电子层数等于该元素所在的周期数 B.元素周期表中从ⅢB族到ⅡB族10个纵列的元素都是金属元素 C.除氦外的稀有气体原子的最外层电子数都是8 D.同一元素的各种同位素化学性质几乎完全相同
|
|
| 2. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.16g18O2的中子数为10NA B.1.9g1H37Cl的电子数为0.9NA C.7.0g35Cl2的体积为 2.24 L D.35Cl2的摩尔质量为 70 g
|
|
| 3. | 详细信息 |
|
下列有关碱金属元素和卤素的说法中,错误的是( ) A.溴单质与H2的反应比碘单质与H2的反应更剧烈 B.碱金属元素中,锂原子还原性最弱;卤素中,氟原子氧化性最强 C.钾与水的反应比钠与水的反应更剧烈 D.随核电荷数的增加,碱金属元素和卤素的单质熔沸点都逐渐降低
|
|
| 4. | 详细信息 |
|
元素的性质随着原子序数的递增呈现周期性的变化的根本原因是( ) A.元素相对原子质量的递增,量变引起质变 B.元素的金属性和非金属性呈周期性变化 C.元素原子核外电子排布呈周期性变化 D.元素化合价呈周期性变化
|
|
| 5. | 详细信息 |
|
下列说法中正确的是( ) A.铊与铝同主族,氧化铝是两性氧化物,所以氧化铊也是两性氧化物 B.第三周期简单离子的半径从左到右依次减小 C.用电子式表示HCl的形成过程 D.在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料
|
|
| 6. | 详细信息 |
|
下列说法正确的是( ) ①离子化合物一定含离子键,也可能含共价键 ②共价化合物一定含共价键,也可能含离子键 ③含金属元素的化合物不一定是离子化合物 ④由非金属元素组成的化合物一定是共价化合物 ⑤由分子组成的物质中一定存在共价键 ⑥离子化合物在熔融状态下能导电 A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
|
|
| 7. | 详细信息 |
|
下列递变规律正确的是( ) A. HClO4、H2SO4、H3PO4的酸性依次增强 B. 钠、镁、铝的还原性依次减弱 C. HCl、HBr、HI的稳定性依次增强 D. 由于非金属性 Cl > Br > I,所以酸性 HCl > HBr > HI
|
|
| 8. | 详细信息 |
|
下列叙述中正确的是( ) A.周期表中第15列元素的最高价氧化物对应水化物的化学式均为H3RO4 B. O22-与 S2-具有相同的质子数和电子数 C.所有主族元素的最高正价均与其族序数相等 D.若 R2- 和 M+ 的电子层结构相同,则原子序数:R>M
|
|
| 9. | 详细信息 |
|
下列说法正确的是( ) A. 干冰升华时,二氧化碳分子中的共价键不发生断裂 B. C(石墨)=C(金刚石),反应中既没有电子的得失也没有能量的变化 C. 凡经加热而发生的化学反应都是吸热反应 D.燃料燃烧时只是将化学能转化为热能
|
|
| 10. | 详细信息 |
|
下列所述变化中,前者是吸热反应,后者是放热反应的是( ) A.Ba(OH)2·8H2O与NH4Cl的反应; 氢氧化钠溶于水 B.点燃的镁条在二氧化碳中继续燃烧; 碳酸氢钠分解 C.灼热的碳与二氧化碳的反应; 氢气在氯气中燃烧 D.酸碱中和; 焦炭与高温水蒸气反应
|
|
| 11. | 详细信息 |
|
下列有关电池的说法不正确的是( ) A.铜锌原电池工作时,电子在电解液中从锌电极流向铜电极 B. 锌锰干电池中,锌电极是负极 C. 氢氧燃料电池可把化学能转化为电能 D. 手机上用的锂离子电池属于二次电池
|
|
| 12. | 详细信息 |
|
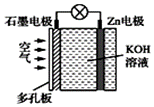
锌空气电池具有蓄电量大、充电循环次数多等优点(Zn与Al的化学性质相似)。下列有关说法错误的是( )
A.电池放电时Zn电极逐渐溶解 B.电池放电时化学能转化为电能 C.电子由石墨经导线流向Zn片 D.石墨为正极
|
|
| 13. | 详细信息 |
|
下列关于化学反应速率的说法正确的是( ) A. 0.1 mol·L-1盐酸和硫酸分别与2 mol·L-1氨水反应速率相同 B. 0.1 mol·L-1盐酸和硝酸与相同形状和大小的大理石反应的速率相同 C. 0.8 mol·L-1·s-1的含义是时间为1s时,某物质的浓度是0.8 mol·L- D. 对于任何化学反应来说,反应速率越大,反应现象就越明显
|
|
| 14. | 详细信息 |
|
在体积固定的密闭容器中,进行的可逆反应为A(固) +3B(气) ①C的生成与分解速率相等 ②单位时间内生成amolA 和3amol B ③B的浓度不再变化 ④混合气体总的物质的量不再发生变化 ⑤A、B、C的物质的量之比为1:3:3 ⑥混合气体的密度不再变化 A.①②③ B.①③④⑥ C.①③⑥ D.①③④⑤
|
|
| 15. | 详细信息 |
|
在4L密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:3A(g)+B(g) A.B的转化率为20% B.平衡时A的浓度为1.50 mol·L﹣1 C.x=1 D.达平衡时,在相同温度下容器内的压强是反应前的85%
|
|
| 16. | 详细信息 |
|
W、X、Y、Z均为短周期主族元素,原子序数依次增加。W原子最外层电子数是其所在周期数的2倍;Y+和X2-的电子层结构相同;Z的原子序数等于W和Y的核外电子数之和。下列说法正确的是( ) A.Z的氢化物的酸性比WX2的水化物的强,说明Z的非金属性比W的强 B.离子半径大小:Z>Y>X C.工业上用MnO2和Z的氢化物的浓溶液在加热的条件下制取Z的单质 D.能形成WX2这种共价化合物
|
|
| 17. | 详细信息 |
|
为探究元素周期表中元素性质的递变规律,设计了如下实验。 Ⅰ.(1)将外观相近的钠、钾、镁、铝各1克分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应的速度最慢;________与盐酸反应产生的气体最多。 (2)向H2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为__________________________________________
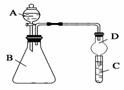
Ⅱ.利用上图装置可验证同主族元素非金属性的变化规律 (3)仪器A的名称为________ (4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_______ _(填现象),即可证明 (5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中________________________(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有________________溶液的洗气瓶除去
|
|
| 18. | 详细信息 |
|
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,所含元素的原子半径由小到大的顺序:_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:___________________ (2)在NaCl、NaOH、N2、H2S中,只含有离子键的是 ,仅含有共价键的化合物是 (3)用电子式表示MgCl2的形成过程 (4)将锌片和银片浸入稀硫酸中组成原电池,若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净,干燥后称重,总质量为47g,则产生氢气的体积 mL(标准状况)
|
|
| 19. | 详细信息 |
|
(1)已知2H→H2放出437.6 kJ的热量,下列说法正确的是_______ A. 氢气分子内每个氢原子都达到稳定结构 B. 氢气分子的能量比两个氢原子的能量低 C. 1 mol H2 离解成 2 mol H 要放出437.6 kJ热量 D. 氢原子比氢气分子稳定 (2)科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术2H2O ①分解海水时,实现了光能转化为______能;生成的氢气用于制作燃料电池时,实现了化学能转化为______能;分解海水的反应属于______反应(填“放热”或“吸热”) ②某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为:2H2 + 2O2‾−4e‾=2H2O,则B极的电极反应式为:_____________________ (3)已知某电池的总反应为:Zn+2MnO2+2NH4Cl=ZnCl2+2NH3↑+Mn2O3+H2O,写出该电池的电极反应方程式:负极________________________ 正极_____________________________
|
|
| 20. | 详细信息 | ||||||||||||||||||||||
|
某探究小组用盐酸与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HCl浓度为1.00mol/L、2. 50mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、40℃,每次实验盐酸的用量为25.00mL,大理石用量为10.00g。 (1)写出盐酸与大理石反应的化学方程式 (2)请完成以下实验设计表,并把实验中空缺处补充完整:
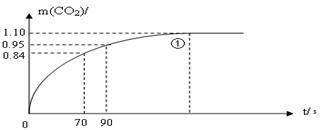
(3)实验①中CO2质量随时间变化的关系见下图。计算实验①中70s-90s范围内用HCl表示的平均反应速率 (忽略溶液体积变化)
|
|||||||||||||||||||||||