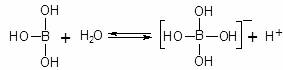2016жұҹиӢҸй«ҳдёүдёӢеӯҰжңҹиӢҸж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
иӣӢзҷҪиҙЁе®Ңе…ЁзҮғзғ§еҗҺпјҢдә§зү©дёҚеҗ«жңүзҡ„зү©иҙЁжҳҜвҖҰ(В В В ) A.N2В В В В В В В В В В В В В В В В В В В B.CO2 В В В В В В В В В В В В В В В C.SO2В В В В В В В В В В В В В В В В D.NO
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯпјҢдё»иҰҒжҲҗеҲҶеұһдәҺзЎ…й…ёзӣҗзҡ„жҳҜ AпјҺзғ§зўұВ В В В В BпјҺж°ҙжіҘ В В В В В В В CпјҺзҹізҒ°зҹіВ В В В В В В В DпјҺиғҶзҹҫ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
йҮ‘еұһй’ зқҖзҒ«пјҢз”ЁдёӢеҲ—е“Әз§Қзү©иҙЁзҒӯзҒ« AпјҺж°ҙВ В В В В В В В В В В В В В BпјҺжіЎжІ«зҒӯзҒ«еҷЁ CпјҺе№ІзҮҘзҡ„жІҷеңҹВ В В В В В DпјҺе№ІеҶ°зҒӯзҒ«еҷЁ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
йҡҸзқҖдәә们з”ҹжҙ»иҠӮеҘҸзҡ„еҠ еҝ«пјҢж–№дҫҝзҡ„е°ҸеҢ…иЈ…йЈҹе“Ғе·Іиў«е№ҝжіӣжҺҘеҸ—пјҺдёәдәҶ延й•ҝйЈҹе“Ғзҡ„дҝқиҙЁжңҹпјҢйҳІжӯўйЈҹе“ҒеҸ—жҪ®еҸҠеҜҢи„ӮйЈҹе“Ғж°§еҢ–еҸҳиҙЁпјҢеңЁеҢ…иЈ…иўӢдёӯеә”ж”ҫе…Ҙзҡ„еҢ–еӯҰзү©иҙЁжҳҜ AпјҺж— ж°ҙзЎ«й…ёй“ңгҖҒи”—зі–В В В BпјҺз”ҹзҹізҒ°гҖҒйЈҹзӣҗ CпјҺз”ҹзҹізҒ°гҖҒзЎ«й…ёдәҡй“ҒВ В В DпјҺйЈҹзӣҗгҖҒзЎ«й…ёдәҡй“Ғ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
зЎјй…ёпјҲH3BO3пјүеҲҶеӯҗзҡ„дёӯеҝғеҺҹеӯҗBжңҖеӨ–еұӮз”өеӯҗ并жңӘиҫҫеҲ°йҘұе’ҢпјҢе®ғеңЁж°ҙдёӯз»“еҗҲж°ҙеҲҶеӯҗз”өзҰ»еҮәжқҘзҡ„OH-дҪҝBеҺҹеӯҗжңҖеӨ–еұӮз”өеӯҗиҫҫеҲ°йҘұе’ҢпјҢз”өзҰ»иҝҮзЁӢеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иЎЁиҝ°жӯЈзЎ®зҡ„жҳҜ
AпјҺзЎјй…ёеҠ е…Ҙж°ҙдёӯжҠ‘еҲ¶ж°ҙзҡ„з”өзҰ»В В В В В В В В В В В В В В В В В В В В В В В В BпјҺзЎјй…ёжҳҜдёүе…ғй…ё CпјҺзЎјй…ёдёҺејәзўұеңЁжә¶ж¶ІдёӯеҸҚеә”пјҡH3BO3+OHпјҚпјқ[B(OH)4]пјҚ В В В В В DпјҺзЎјй…ёжҳҜдёӨжҖ§еҢ–еҗҲзү©
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
2011е№ҙ3жңҲ11ж—ҘеңЁж—Ҙжң¬еҸ‘з”ҹзҡ„еӨ§ең°йңҮдёӯпјҢзҰҸеІӣж ёз”өз«ҷеҸ‘з”ҹдәҶж ёжі„жјҸпјҢе…¶е‘Ёиҫ№еҢәеҹҹзҡ„з©әж°”дёӯжјӮжө®зқҖж”ҫе°„жҖ§зү©иҙЁпјҢе…¶дёӯеҗ«жңүзўҳзҡ„еҗҢдҪҚзҙ 131В 53IпјҢ131В 53Iдёӯзҡ„дёӯеӯҗж•°дёә A. 53В В В В В B. 78В В В В В C. 131В В В В D. 184
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
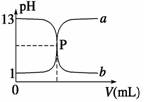
еҰӮеӣҫжӣІзәҝaе’ҢbжҳҜзӣҗй…ёдёҺж°ўж°§еҢ–й’ зӣёдә’ж»ҙе®ҡзҡ„ж»ҙе®ҡжӣІзәҝпјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ
AпјҺзӣҗй…ёзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә1 molВ·LпјҚ1 BпјҺPзӮ№ж—¶жҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢжә¶ж¶Іе‘ҲдёӯжҖ§ CпјҺжӣІзәҝaжҳҜзӣҗй…ёж»ҙе®ҡж°ўж°§еҢ–й’ зҡ„ж»ҙе®ҡжӣІзәҝ DпјҺй…ҡй…һдёҚиғҪз”ЁдҪңжң¬е®һйӘҢзҡ„жҢҮзӨәеүӮ
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ідәҺдҪҝз”ЁйЈҹе“Ғж·»еҠ еүӮеҲ©ејҠзҡ„и®әзӮ№жӯЈзЎ®зҡ„жҳҜ AгҖҒиҝҮйҮҸдҪҝз”ЁеӣҪ家е…Ғи®ёдҪҝз”Ёзҡ„йЈҹе“Ғж·»еҠ еүӮпјҢеҜ№дәәдҪ“ж— е®і BгҖҒйЈҹз”ЁйЈҹе“Ғж·»еҠ еүӮпјҢиғҪдҪҝйЈҹзү©зҡ„иүІгҖҒйҰҷгҖҒе‘ідҝұдҪіпјҢиҝҷж ·зҡ„йЈҹзү©йҖӮеҗҲе„ҝз«ҘйЈҹз”Ё CгҖҒйҳІи…җеүӮеҸҜд»Ҙ延й•ҝйЈҹе“Ғзҡ„дҝқеӯҳжңҹпјҢеҮҸе°‘йЈҹе“ҒеҸҳиҙЁе’ҢжөӘиҙ№пјҢжүҖд»ҘеҸҜд»ҘеӨҡеҠ дёҖдәӣ DгҖҒйЈҹз”ЁдәҡзЎқй…ёй’ жңүеҸҜиғҪиҮҙзҷҢ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁзҡ„еҲ¶еӨҮеҗҲзҗҶзҡ„жҳҜ в‘ е°Ҷж°ҜеҢ–й“қдёҺзЎ«еҢ–й’ҫжә¶ж¶Іж··еҗҲеҗҺиҝҮж»ӨжқҘеҲ¶еӨҮзЎ«еҢ–й“қв‘Ўе°ҶиҝҮйҮҸзҡ„й“ҒдёҺж°Ҝж°”еҠ зғӯеҸҚеә”еҲ¶еӨҮж°ҜеҢ–дәҡй“Ғв‘ўеңЁй…ҚеҲ¶зҡ„зЎ«й…ёдәҡй“Ғжә¶ж¶ІеёёеҠ е…ҘдёҖе®ҡйҮҸзҡ„й“ҒзІүе’ҢзЎ«й…ёв‘Јй“ңе…Ҳж°§еҢ–жҲҗж°§еҢ–й“ңпјҢеҶҚдёҺзЎ«й…ёеҸҚеә”жқҘеҲ¶еҸ–зЎ«й…ёй“ңв‘Өе°Ҷ45mLеҶ°еҠ е…ҘеҲ°зӣӣжңү5gж°ҜеҢ–й’ зҡ„зғ§жқҜдёӯпјҢжә¶и§Јй…ҚеҲ¶50gиҙЁйҮҸеҲҶж•°дёә5пј…зҡ„ж°ҜеҢ–й’ жә¶ж¶І AпјҺеҸӘжңүв‘ЈВ В В В В BпјҺеҸӘжңүв‘Ўв‘ўВ В В В В CпјҺеҸӘжңүв‘ўв‘ЈВ В В В DпјҺе…ЁйғЁ
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺж №жҚ®зәўеӨ–е…үи°ұеӣҫзҡ„еҲҶжһҗеҸҜд»ҘеҲқжӯҘеҲӨж–ӯжңүжңәзү©дёӯе…·жңүе“Әдәӣеҹәеӣў BпјҺз”Ізғ·гҖҒд№ҷзғҜе’ҢиӢҜеңЁе·ҘдёҡдёҠйғҪйҖҡиҝҮзҹіжІ№еҲҶйҰҸеҫ—еҲ° CпјҺеҗ‘иӣӢзҷҪиҙЁжә¶ж¶ІдёӯеҠ е…ҘзЎ«й…ёй“ңжә¶ж¶ІпјҢе°Ҷеҫ—еҲ°зҡ„жІүж·ҖеҲҶзҰ»еҮәжқҘпјҢеҶҚеҠ ж°ҙеҸҜйҮҚж–°жә¶и§Ј DпјҺ1Hж ёзЈҒе…ұжҢҜи°ұиғҪеҸҚжҳ еҮәжңүжңәзү©дёӯдёҚеҗҢзҺҜеўғж°ўеҺҹеӯҗзҡ„з§Қзұ»е’ҢдёӘж•°
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еұһдәҺејәз”өи§ЈиҙЁзҡ„жҳҜ AпјҺCuВ В В В В BпјҺCH3COONH4В В В В В В CпјҺCH3COOHВ В В В В В DпјҺNH3В·H2O
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
ngиҮӯж°§(O3)дёӯжңүmдёӘж°§еҺҹеӯҗпјҢеҲҷйҳҝдјҸдјҪеҫ·зҪ—еёёж•°N Aзҡ„ж•°еҖјеҸҜиЎЁзӨәдёә В AпјҺn/16mВ В В В В BпјҺn/48mВ В В В В В В В В CпјҺ16m/nВ В В В В В В В DпјҺ48m/n
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸдёӯжӯЈзЎ®зҡ„жҳҜ(В ) AпјҺеҗ‘жә¶ж¶ІNa2FeO4дёӯеҠ е…ҘзЁҖH2SO4дә§з”ҹж°§ж°”пјҡ4FeO42пјҚпјӢ2OHпјҚпјқ4Fe2пјӢпјӢ3O2вҶ‘пјӢ10H2O BпјҺеҗ‘жә¶ж¶ІNH4Al(SO4)2дёӯж»ҙе…Ҙжә¶ж¶ІBa(OH)2жҒ°еҘҪдҪҝ(SO4)2пјҚжІүж·Җе®Ңе…Ё2Ba2пјӢпјӢ4OHпјҚпјӢAl3пјӢпјӢ2SO42пјҚпјқ2BaSO4вҶ“пјӢAlO2пјҚпјӢ2H2O CпјҺеҗ‘жә¶ж¶ІMg(HCO3)2дёӯеҠ е…ҘиҝҮйҮҸзҡ„NaOHжә¶ж¶ІпјҡMg2пјӢпјӢ2HCO3пјҚпјӢ4OHпјҚпјқMg(OH)2вҶ“пјӢ2CO32пјҚпјӢ2H2O DпјҺеҗ‘жә¶ж¶ІFe(NO3)2дёӯеҠ е…ҘзЁҖж°ўзўҳй…ёпјҡ3 Fe2пјӢпјӢ4HпјӢNO3пјҚпјқ3 Fe3пјӢпјӢNOвҶ‘пјӢ2H2O
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
е®һйӘҢе®ӨеҲ¶еӨҮиӢҜз”ІйҶҮе’ҢиӢҜз”Ій…ёзҡ„еҢ–еӯҰеҺҹзҗҶжҳҜ
е·ІзҹҘиӢҜз”ІйҶӣжҳ“иў«з©әж°”ж°§еҢ–пјҢиӢҜз”ІйҶҮзҡ„жІёзӮ№дёә205.3 в„ғпјҢиӢҜз”Ій…ёзҡ„зҶ”зӮ№дёә121.7 в„ғпјҢжІёзӮ№дёә249 в„ғпјҢжә¶и§ЈеәҰдёә0.34 gпјӣд№ҷйҶҡзҡ„жІёзӮ№дёә34.8 в„ғпјҢйҡҫжә¶дәҺж°ҙгҖӮеҲ¶еӨҮиӢҜз”ІйҶҮе’ҢиӢҜз”Ій…ёзҡ„дё»иҰҒиҝҮзЁӢеҰӮдёӢжүҖзӨә иҜ•ж №жҚ®дёҠиҝ°дҝЎжҒҜпјҢеҲӨж–ӯд»ҘдёӢиҜҙжі•й”ҷиҜҜзҡ„жҳҜ AпјҺж“ҚдҪңв… жҳҜиҗғеҸ–еҲҶж¶ІВ В В В BпјҺд№ҷйҶҡжә¶ж¶ІдёӯжүҖжә¶и§Јзҡ„дё»иҰҒжҲҗеҲҶжҳҜиӢҜз”ІйҶҮ CпјҺж“ҚдҪңв…Ўи’ёйҰҸжүҖеҫ—дә§е“Ғз”ІжҳҜиӢҜз”ІйҶҮВ DпјҺж“ҚдҪңв…ўиҝҮж»Өеҫ—еҲ°дә§е“Ғд№ҷжҳҜиӢҜз”Ій…ёй’ҫ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗе·Ҙдёҡеәҹж°ҙд»…еҗ«дёӢиЎЁдёӯзҡ„жҹҗдәӣзҰ»еӯҗпјҢдё”еҗ„з§ҚзҰ»еӯҗзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰзӣёзӯүпјҢеқҮдёә0. 1mol/LпјҲжӯӨж•°еҖјеҝҪз•Ҙж°ҙзҡ„з”өзҰ»еҸҠзҰ»еӯҗзҡ„ж°ҙи§ЈпјүгҖӮ з”ІеҗҢеӯҰж¬ІжҺўз©¶еәҹж°ҙзҡ„з»„жҲҗпјҢиҝӣиЎҢдәҶеҰӮдёӢе®һйӘҢпјҡ
в… гҖҒеҸ–иҜҘж— иүІжә¶ж¶І5mLпјҢж»ҙеҠ дёҖж»ҙж°Ёж°ҙжңүжІүж·Җз”ҹжҲҗпјҢдё”зҰ»еӯҗз§Қзұ»еўһеҠ гҖӮ в…ЎгҖҒз”Ёй“ӮдёқиҳёеҸ–жә¶ж¶ІпјҢеңЁзҒ«з„°дёҠзҒјзғ§пјҢйҖҸиҝҮи“қиүІй’ҙзҺ»з’ғи§ӮеҜҹпјҢж— зҙ«иүІзҒ«з„°гҖӮ в…ўгҖҒеҸҰеҸ–жә¶ж¶ІеҠ дәәиҝҮйҮҸзӣҗй…ёпјҢжңүж— иүІж°”дҪ“з”ҹжҲҗпјҢиҜҘж— иүІж°”дҪ“йҒҮз©әж°”еҸҳжҲҗзәўжЈ•иүІгҖӮ IVгҖҒеҗ‘в…ўдёӯжүҖеҫ—зҡ„жә¶ж¶ІдёӯеҠ е…ҘBaCl2жә¶ж¶ІпјҢжңүзҷҪиүІжІүж·Җз”ҹжҲҗгҖӮ дёӢеҲ—жҺЁж–ӯдёҚжӯЈзЎ®зҡ„жҳҜпјҡ AпјҺз”ұв… гҖҒв…ЎеҲӨж–ӯпјҢжә¶ж¶ІдёӯдёҖе®ҡдёҚеҗ«жңүзҡ„йҳізҰ»еӯҗжҳҜK+гҖҒNH4+гҖҒCu2+ BпјҺв…ўдёӯеҠ дәәзӣҗй…ёз”ҹжҲҗж— иүІж°”дҪ“зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜ6I-+2NO3-+8H+в•җ3I2+2NOвҶ‘+4H2O CпјҺеҺҹжә¶ж¶ІдёҖе®ҡеҸӘеҗ«жңүзҡ„зҰ»еӯҗI-гҖҒNO3-пјҢSO42-пјҢMg2+гҖҒAl3+ DпјҺеҸҰеҸ–1OOmLеҺҹжә¶ж¶ІпјҢеҠ е…Ҙи¶ійҮҸзҡ„NaOHжә¶ж¶ІпјҢе……еҲҶеҸҚеә”еҗҺиҝҮж»ӨпјҢжҙ—ж¶ӨпјҢзҒјзғ§жІүж·ҖиҮіжҒ’йҮҚпјҢеҫ—еҲ°зҡ„еӣәдҪ“иҙЁйҮҸдёә0.4 g
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
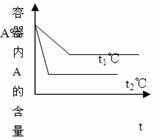
еңЁдёҖеҜҶй—ӯе®№еҷЁдёӯпјҢеҸ‘з”ҹеҸҜйҖҶеҸҚеә” aA(g)+bB(g)
иҜ•жҚ®еӣҫеӣһзӯ”пјҡ пјҲ1пјүеҺӢејәP1В В В В В P2пјҢa+bВ В В В В В c+dВ пјҲеЎ«<гҖҒ>гҖҒ=пјү пјҲ2пјүжё©еәҰt1в„ғжҜ”t2в„ғВ В В В В В пјҲеЎ«й«ҳжҲ–дҪҺпјүпјҢжӯЈж–№еҗ‘дёәВ В В В еҸҚеә”гҖӮпјҲеЎ«ж”ҫзғӯжҲ–еҗёзғӯпјү
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ҘдёҡдёҠжҺҘи§Ұжі•еҲ¶зЎ«й…ёиҝҮзЁӢдёӯпјҢеңЁжІёи…ҫзӮүдёӯз……зғ§зЎ«й“ҒзҹҝпјҲдё»иҰҒжҲҗеҲҶдёәFeS2пјүзҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡ4 FeS2 + 11O2 иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүе·ІзҹҘSдёә -1д»·пјҢеҲҷиў«ж°§еҢ–зҡ„е…ғзҙ жҳҜВ В В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүиӢҘз……зғ§1.0 tзҡ„зЎ«й“ҒзҹҝпјҲжқӮиҙЁеҗ«йҮҸдёә30%пјҢжқӮиҙЁдёӯдёҚеҗ«зЎ«е…ғзҙ пјүпјҢдё”FeS2зҡ„иҪ¬еҢ–зҺҮдёә90%пјҢеҲҷж ҮеҮҶзҠ¶еҶөдёӢпјҢз”ҹжҲҗзҡ„SO2дҪ“з§ҜдёәВ В В В В В В В В В В В В В В В m3гҖӮ пјҲ3пјүиӢҘзЎ«й“Ғзҹҝз……зғ§дёҚе……еҲҶпјҢеҲҷзӮүжёЈдёӯж··жңү+2д»·зҡ„й“Ғе…ғзҙ пјҢиҜ•и®ҫи®ЎдёҖдёӘз®ҖеҚ•зҡ„е®һйӘҢиҜҒжҳҺд№ӢгҖӮз®Җиҝ°е®һйӘҢж“ҚдҪңе’Ңжңүе…ізҡ„е®һйӘҢзҺ°иұЎВ В В В В В В В В В В В В В В В В В В В В гҖӮ дҫӣйҖүжӢ©зҡ„иҜ•еүӮпјҡCuSO4жә¶ж¶ІгҖҒзЁҖзЎ«й…ёгҖҒKMnO4жә¶ж¶ІгҖҒе“Ғзәўжә¶ж¶ІгҖҒNaOH жә¶ж¶Ізӯү пјҲ4пјүзӮүжёЈз»ҸжҸҗзәҜеҸҜеҲ¶еҫ—FeCl3пјҢз”өеӯҗе·ҘдёҡйңҖиҰҒз”Ё30пј…зҡ„FeCl3жә¶ж¶Іи…җиҡҖж•·еңЁз»қзјҳжқҝдёҠзҡ„й“ңпјҢеҲ¶йҖ еҚ°еҲ·з”өи·ҜзүҲгҖӮиҜ·еҶҷеҮәFeCl3жә¶ж¶ІдёҺй“ңеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В гҖӮжЈҖйӘҢеҸҚеә”еҗҺзҡ„жә¶ж¶ІдёӯеӯҳеңЁFe3+зҡ„иҜ•еүӮеҸҜз”ЁВ В В В В В В В В В В В В В В гҖӮж¬Ід»Һи…җиҡҖеҗҺзҡ„еәҹж¶Ідёӯеӣһ收й“ң并йҮҚж–°иҺ·еҫ—FeCl3жә¶ж¶ІпјҢдёӢеҲ—иҜ•еүӮдёӯпјҢйңҖиҰҒз”ЁеҲ°зҡ„дёҖз»„жҳҜ(еЎ«еӯ—жҜҚ)В В В В В В В В В В В В В В гҖӮ в‘ и’ёйҰҸж°ҙВ В в‘Ўй“ҒзІүВ в‘ўжө“зЎқй…ёВ в‘ЈзЁҖзӣҗй…ёВ В в‘Өжө“ж°Ёж°ҙВ в‘Ҙж°Ҝж°ҙ AпјҺв‘ в‘Ўв‘Јв‘ҘВ В В В В В BпјҺв‘ в‘ўв‘Јв‘ҘВ В В В В В В В CпјҺв‘Ўв‘Јв‘ӨВ В В В В В DпјҺв‘ в‘Јв‘Ҙ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
й“ңж—ўиғҪдёҺзЁҖзЎқй…ёеҸҚеә”пјҢд№ҹиғҪдёҺжө“зЎқй…ёеҸҚеә”пјҢеҪ“й“ңдёҺдёҖе®ҡжө“еәҰзЎқй…ёеҸҚеә”ж—¶пјҢеҸҜе°Ҷж–№зЁӢејҸиЎЁзӨәдёәпјҡCuпјӢHNO3вҖ•вҶ’Cu(NO3)2пјӢNOвҶ‘пјӢNO2вҶ‘пјӢH2O(ж–№зЁӢејҸжңӘй…Қе№іпјҢдёҚиҖғиҷ‘2NO2N2O4)гҖӮ (1)зЎқй…ёеңЁиҜҘеҸҚеә”дёӯдҪ“зҺ°зҡ„жҖ§иҙЁжҳҜ________гҖӮ (2)0.004 mol Cuиў«зЎқй…ёе®Ңе…Ёжә¶и§ЈеҗҺпјҢCuеӨұеҺ»зҡ„з”өеӯҗж•°жҳҜ________пјҢеҰӮжһңеҫ—еҲ°зҡ„NOе’ҢNO2зү©иҙЁзҡ„йҮҸзӣёеҗҢпјҢеҲҷеҸӮеҠ еҸҚеә”зҡ„зЎқй…ёзҡ„зү©иҙЁзҡ„йҮҸжҳҜ________пјҢеңЁж ҮеҮҶзҠ¶еҶөдёӢиӢҘе°Ҷ收йӣҶNOе’ҢNO2зҡ„йӣҶ气瓶еҖ’з«ӢдәҺж°ҙдёӯпјҢйҖҡе…ҘдёҖе®ҡйҮҸзҡ„ж°§ж°”е……еҲҶеҸҚеә”еҗҺеҸ‘зҺ°ж— ж°”дҪ“еү©дҪҷпјҢеҲҷйҖҡе…ҘO2зҡ„дҪ“з§Ҝдёә________пјӣжүҖеҫ—жә¶ж¶І(еҒҮи®ҫжә¶иҙЁдёҚжү©ж•Ј)зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰжҳҜ________гҖӮ (3)еҰӮжһңеҸӮеҠ еҸҚеә”зҡ„Cuе’ҢHNO3зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”жҳҜ3вҲ¶10пјҢеҶҷеҮә并й…Қе№іиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ______________________________________гҖӮ (4)еҰӮжһңжІЎжңүеҜ№иҜҘеҸҚеә”дёӯзҡ„жҹҗдәӣзү©иҙЁзҡ„жҜ”дҫӢдҪңйҷҗе®ҡпјҢеҲҷж–№зЁӢејҸеҸҜиғҪзҡ„й…Қе№ізі»ж•°жңүи®ёеӨҡз»„гҖӮеҺҹеӣ жҳҜ____________________________________гҖӮ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
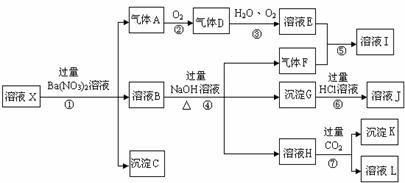
жҹҗејәй…ёжҖ§жә¶ж¶ІXпјҢеҗ«жңүBa2+гҖҒAl3+гҖҒSiO32пјҚгҖҒNH4+гҖҒFe2+гҖҒFe3+гҖҒCO32пјҚгҖҒSO42пјҚгҖҒNO3пјҚдёӯзҡ„дёҖз§ҚжҲ–еҮ з§ҚзҰ»еӯҗпјҢеҸ–жә¶ж¶ІиҝӣиЎҢиҝһз»ӯе®һйӘҢпјҢиғҪе®һзҺ°еҰӮдёӢиҪ¬еҢ–пјҡ
дҫқжҚ®д»ҘдёҠдҝЎжҒҜпјҢеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүдёҠиҝ°зҰ»еӯҗдёӯпјҢжә¶ж¶ІXдёӯиӮҜе®ҡеҗ«жңүзҡ„жҳҜпјҡ________________пјӣдёҚиғҪиӮҜе®ҡзҡ„жҳҜпјҡ_______________гҖӮеҜ№дёҚиғҪзЎ®е®ҡжҳҜеҗҰеӯҳеңЁзҡ„зҰ»еӯҗпјҢеҸҜд»ҘеҸҰеҸ–Xжә¶ж¶ІдәҺдёҖж”ҜиҜ•з®ЎдёӯпјҢйҖүжӢ©дёӢеҲ—иҜ•еүӮдёӯзҡ„дёҖз§ҚеҠ е…ҘXжә¶ж¶ІдёӯпјҢж №жҚ®зҺ°иұЎе°ұеҸҜеҲӨж–ӯпјҢеҲҷиҜҘиҜ•еүӮжҳҜпјҡ_________гҖӮпјҲйҖүеЎ«пјҡв‘ NaOHжә¶ж¶ІпјҢв‘Ўй…ҡй…һиҜ•еүӮпјҢв‘ўзҹіи•ҠиҜ•еүӮпјҢв‘ЈpHиҜ•зәёпјҢв‘ӨKSCNжә¶ж¶ІпјҢв‘ҘKMnO4жә¶ж¶Іпјү пјҲ2пјүж°”дҪ“Fзҡ„з”өеӯҗејҸдёәпјҡ_______________пјҢе®һйӘҢдёӯпјҢеҸҜд»Ҙи§ӮеҜҹеҲ°еҸҚеә”в‘Ўзҡ„зҺ°иұЎжҳҜпјҡ__________________гҖӮ пјҲ3пјүеҶҷеҮәжӯҘйӘӨв‘ жүҖжңүеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ________________________гҖҒ___________________гҖӮ
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
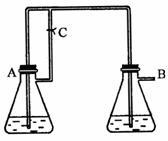
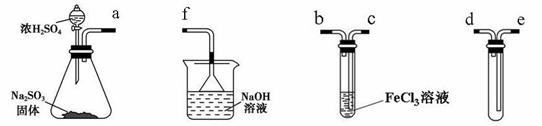
жҹҗз ”з©¶жҖ§еӯҰд№ е°Ҹз»„з”ЁдёӢеӣҫиЈ…зҪ®иҝӣиЎҢSO2дёҺFeCl3жә¶ж¶ІеҸҚеә”зҡ„зӣёе…іе®һйӘҢ(еӨ№жҢҒиЈ…зҪ®е·Із•ҘеҺ»)гҖӮ
пјҲ1пјүеңЁй…ҚеҲ¶ж°ҜеҢ–й“Ғжә¶ж¶Іж—¶пјҢйңҖе…ҲжҠҠж°ҜеҢ–й“Ғжҷ¶дҪ“жә¶и§ЈеңЁ________дёӯпјҢеҶҚеҠ ж°ҙзЁҖйҮҠгҖӮ пјҲ2пјүз»„иЈ…д»ӘеҷЁжҢүж°”жөҒж–№еҗ‘жӯЈзЎ®зҡ„иҝһжҺҘйЎәеәҸжҳҜaжҺҘ____пјҢ____жҺҘ____пјҢ____жҺҘ____гҖӮ пјҲ3пјүзғ§жқҜдёӯеҖ’зҪ®жјҸж–—зҡ„дҪңз”ЁжҳҜ______________________________________гҖӮ пјҲ4пјүеҫҖFeCl3жә¶ж¶ІдёӯйҖҡе…Ҙи¶ійҮҸSO2ж—¶пјҢи§ӮеҜҹеҲ°зҡ„зҺ°иұЎдёә_______________________гҖӮ пјҲ5пјүж №жҚ®д»ҘдёҠзҺ°иұЎпјҢиҜҘе°Ҹз»„еҗҢеӯҰи®ӨдёәSO2дёҺFeCl3жә¶ж¶ІеҸ‘з”ҹдәҶж°§еҢ–иҝҳеҺҹеҸҚеә”гҖӮ в‘ еҶҷеҮәSO2дёҺFeCl3жә¶ж¶ІеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ___________________________пјӣ в‘ЎиҜ·и®ҫи®Ўе®һйӘҢж–№жЎҲжЈҖйӘҢжңүFe2пјӢз”ҹжҲҗпјҡ__________________________________пјӣ в‘ўиҜҘе°Ҹз»„еҗҢеӯҰеҗ‘зӣӣиЈ…FeCl3иҜ•з®ЎеҸҚеә”еҗҺзҡ„жә¶ж¶ІдёӯеҠ е…ҘзЎқй…ёй…ёеҢ–зҡ„BaCl2жә¶ж¶ІпјҢиӢҘеҮәзҺ°зҷҪиүІжІүж·ҖпјҢеҚіеҸҜиҜҒжҳҺеҸҚеә”з”ҹжҲҗдәҶSO42-гҖӮиҜҘеҒҡжі•дёҚеҗҲзҗҶпјҢзҗҶз”ұжҳҜ_________________
|
|
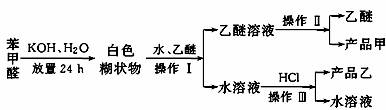
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
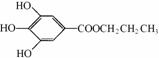
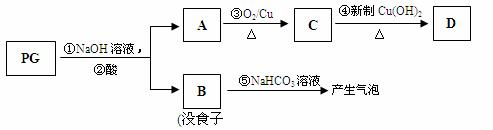
жІЎйЈҹеӯҗй…ёдёҷй…Ҝз®Җз§°PGпјҢз»“жһ„з®ҖејҸдёә пјҲ1пјүPGзҡ„еҲҶеӯҗејҸдёәВ В В В В В В В В В В пјҢиҜ·еҶҷеҮәPGеҲҶеӯҗдёӯжүҖеҗ«е®ҳиғҪеӣўзҡ„еҗҚз§°В В В В В В В В В В В В В В В пјҢ1molPGдёҺи¶ійҮҸж°ўж°§еҢ–й’ жә¶ж¶Іе®Ңе…ЁеҸҚеә”ж—¶пјҢж¶ҲиҖ—зҡ„ж°ўж°§еҢ–й’ зҡ„зү©иҙЁзҡ„йҮҸжҳҜВ В В В В В В В В В В гҖӮ PGеҸҜеҸ‘з”ҹеҰӮдёӢиҪ¬еҢ–пјҡ
пјҲ2пјүAзҡ„з»“жһ„з®ҖејҸдёә В В В В В В В В В В В В В В В В В В В В В В пјҢ1molжІЎйЈҹеӯҗй…ёжңҖеӨҡеҸҜдёҺВ В В В mol H2 еҠ жҲҗгҖӮ пјҲ3пјүдёҠеӣҫзҡ„жңүе…іеҸҳеҢ–дёӯпјҢеұһдәҺж°§еҢ–еҸҚеә”зҡ„жңүпјҲеЎ«еәҸеҸ·пјүВ В В В В В В В В В В В В гҖӮ пјҲ4пјүд»ҺеҲҶеӯҗз»“жһ„жҲ–жҖ§иҙЁдёҠзңӢпјҢPGе…·жңүжҠ—ж°§еҢ–дҪңз”Ёзҡ„дё»иҰҒеҺҹеӣ жҳҜ(еЎ«еәҸеҸ·)В В В В В В В В В В гҖӮ aпјҺеҗ«жңүиӢҜзҺҜВ В В В В bпјҺеҗ«жңүзҫ§еҹәВ В В В cпјҺеҗ«жңүй…ҡзҫҹеҹәВ В В В В dпјҺеҫ®жә¶дәҺйЈҹз”ЁжІ№ пјҲ5пјүеҸҚеә”в‘Јзҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡВ В В В В В В В В В В В В гҖӮ пјҲ6пјүBжңүеӨҡз§ҚеҗҢеҲҶејӮжһ„дҪ“пјҢеҶҷеҮәе…¶дёӯз¬ҰеҗҲдёӢеҲ—иҰҒжұӮзҡ„еҗҢеҲҶејӮжһ„дҪ“зҡ„з»“жһ„з®ҖејҸпјҡВ В В В В В В В В В В В В гҖӮ iпјҺеҗ«жңүиӢҜзҺҜпјҢдё”иӢҜзҺҜдёҠзҡ„дёҖжәҙд»Јзү©еҸӘжңүдёҖз§Қпјӣ iiпјҺж—ўиғҪеҸ‘з”ҹ银й•ңеҸҚеә”пјҢеҸҲиғҪеҸ‘з”ҹж°ҙи§ЈеҸҚеә”гҖӮ
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
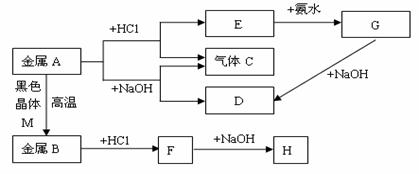
зҺ°жңүеёёи§ҒйҮ‘еұһAгҖҒBпјҢе®ғ们д№Ӣй—ҙеӯҳеңЁеҰӮдёӢзҡ„иҪ¬еҢ–е…ізі»пјҲеӣҫдёӯжңүдәӣеҸҚеә”зҡ„дә§зү©е’ҢеҸҚеә”зҡ„жқЎд»¶жІЎжңүе…ЁйғЁж ҮеҮәпјүпјҢе…¶дёӯGгҖҒHдёәзҷҪиүІжІүж·ҖгҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
пјҲ1пјүеҶҷеҮәйҮ‘еұһAе’Ңзү©иҙЁDзҡ„еҗҚз§°жҲ–еҢ–еӯҰејҸпјҡВ В В В В В В В В В гҖҒВ В В В В В В В В В гҖӮ пјҲ2пјүеҶҷеҮәEиҪ¬еҢ–дёәGзҡ„зҰ»еӯҗж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В пјӣ пјҲ3пјүеҶҷеҮәHж”ҫеңЁз©әж°”дёӯзҡ„зҺ°иұЎпјҡВ В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ4пјүеҶҷеҮәHж”ҫеңЁз©әж°”дёӯзҡ„еҢ–еӯҰж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В В В В В В гҖӮ
|
|
- жұҹиҘҝзңҒеҗүе®үеёӮж°ёдё°еҺҝж°ёдё°дёӯеӯҰ2021еұҠй«ҳдёүдёҠеӯҰжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰйўҳеҗҢжӯҘи®ӯз»ғе…Қиҙ№иҜ•еҚ·
- 2019-2020е№ҙй«ҳдёӯжҜ•дёҡзҸӯйҳ¶ж®өжҖ§жөӢиҜ•еҢ–еӯҰиҜ•еҚ·пјҲеӨ©дёҖеӨ§иҒ”иҖғпјү
- еӨ©жҙҘеёӮй«ҳдёүеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·ж‘ёеә•иҖғиҜ•йўҳ
- еӨ§еәҶеёӮй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•иҖғйўҳеҗҢжӯҘи®ӯз»ғ
- ж–Үеұұе·һ马关еҺҝ第дёҖдёӯеӯҰ2019е№ҙй«ҳдәҢдёҠеӯҰжңҹеҢ–еӯҰжңҲиҖғжөӢйӘҢзҪ‘дёҠиҖғиҜ•з»ғд№
- еҚ—е®үеёӮй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҲиҖғиҜ•еҚ·йўҳе…Қиҙ№иҜ•еҚ·
- 2018иҮі2019е№ҙй«ҳдёҖеҗҺеҚҠжңҹ第е…ӯж¬ЎжңҲиҖғеҢ–еӯҰдё“йўҳи®ӯз»ғпјҲжІіеҚ—зңҒеҚ—йҳіеёӮ第дёҖдёӯеӯҰпјү
- 2019е№ҙз§Ӣй«ҳдёүеҢ–еӯҰеӨҚд№ ејәеҢ–з»ғд№ -- ж°§еҢ–иҝҳеҺҹеҸҚеә”