2020陕西高二下学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
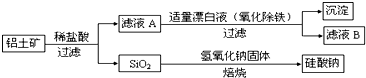
铝元素含量居金属首位, 主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。 Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。 ①该过程中涉及某氧化还原反应如下,请完成: Fe2++□ClO-+□ ═□Fe(OH)3↓+□Cl-+□__________ ②检验滤液B中是否还含有铁元素的方法为:_________________________ ③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________(选填代号) A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳 ④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、__________(填操作名称)、过滤、洗涤。 Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。 (1)明矾曾经是净水明星,用离子方程式表示其净水原理_____________________________。 (2)明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程______________。
|
|
| 2. | 详细信息 |
|
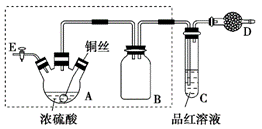
某同学对教材中铜与浓硫酸的实验作出如下改进。实验装置如图所示(加热和夹持装置已略去)。
实验步骤: ①组装仪器,检查装置气密性; ②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化; ③将铜丝上提离开液面,停止加热。 (1)检查虚线框内装置气密性的方法是____________________________。 (2)装置A的名称是________,装置B的作用是_________,装置D中所盛药品是__________。 (3)装置A中发生反应的化学方程式为____________________________。 (4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是__________。 (5)实验后装置A中有白色固体产生,将装置A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是______________;不可直接向装置A中加水的原因是__________。
|
|
| 3. | 详细信息 |
|
海带中碘含量比较高,从海带提取碘的操作如下: (1)将干海带进行灼烧的仪器是____________,海带灰中含有较多KI,将海带灰溶于水,然后过滤得到澄清滤液。 (2)向上述滤液中加入硫酸和H2O2混合溶液,得到棕褐色含有单质碘的水溶液。请写出离子反应方程式:___________________________________________________________。 (3)向上述碘的水溶液中加入适量CCl4,振荡,静置,则I2会转入到CCl4层中,这个过程叫_____________________,现象为________________________________________。 (4)3I2+6KOH=5KI+KIO3+3H2O,1.5mol I2完全反应转移电子的物质的量为_____mol,氧化剂与还原剂的物质的量之比为___________。 (5)某一反应体系有反应物和生成物共6种物质:O2、K2Cr2O7、Cr2(SO4)3、H2SO4、H2O、H2O2、K2SO4。已知该反应中H2O2只发生如下过程:H2O2→O2 ①该反应中,氧化剂为_______________;氧化产物为_______________。 ②写出该反应的化学方程式______________________________________________。
|
|
| 4. | 详细信息 |
|
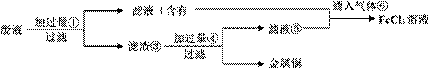
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。 (1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。 (2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。 (3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
请写出上述实验中加入或生成的有关物质的化学式。 ①________,④________。 (4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。 ①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液 A.①③ B.③② C.③① D.①②③ (5)写出向②⑤的混合液中通入⑥的离子方程式:________。
|
|
| 5. | 详细信息 |
|
向一定量的Fe、FeO、Fe2O3的混合物中加入120 mL 4 mol/L的稀硝酸,恰好使混合物完全溶解, 放出1. 344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的CO在加热下还原相同质量的混合物,能得到铁的物质的量为( ) A. 0. 24 mol B. 0. 21 mol C. 0. 16 mol D. 0. 14 mol
|
|
| 6. | 详细信息 |
|
把4.48 LCO2通过一定量的固体过氧化钠后收集到3.36L气体(标况下),则这3.36L气体的质量是( ) A 3.8g B. 4.8g C. 5.6g D. 6.0g
|
|
| 7. | 详细信息 |
|
已知三个氧化还原反应:①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,③2KMnO4+16HCl(浓)= 2KCl+2MnCl2+8H2O+5Cl2↑。若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是( ) A. Cl2 B. KMnO4 C. FeCl3 D. HCl
|
|
| 8. | 详细信息 |
|
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol·L-1和2mol·L-1,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(假设反应中HNO3的还原产物全部为NO) A. 224mL B. 448mL C. 672mL D. 896mL
|
|
| 9. | 详细信息 |
|
高铁酸钾纯品为暗紫色有光泽粉末。在198 A. 由上述反应可知,Fe(OH)3的氧化性强于 B. 高铁酸钾中铁显 + 6价 C. 上述反应氧化剂和还原剂的物质的量之比为3 : 2 D. K2FeO4处理水时,不仅能消毒杀菌,而且生成Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质
|
|
| 10. | 详细信息 |
|
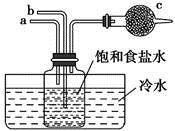
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
A. a通入CO2,然后b通入NH3,c中放碱石灰 B. b通入NH3,然后a通入CO2,c中放碱石灰 C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉 D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
|
|
| 11. | 详细信息 |
|
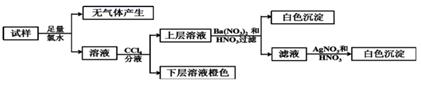
某无色溶液中可能含有Ba2+、Fe3+、Na+、K+、
A. Ba2+、Fe3+、 B. 原溶液肯定不含 C. 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响 D.
|
|
| 12. | 详细信息 |
|
下列离子方程式书写正确的是( ) A. 制取Fe(OH)3胶体:Fe3+ +3H2O B. 锅炉除水垢时先用纯碱浸泡:CaSO4 + CO32-= CaCO3+ SO42- C. 泡沫灭火器灭火原理:2Al3+ + 3CO32-+ 3H2O =2Al(OH)3↓+3CO2↑ D. 碳酸钠溶液显碱性:CO32-+2H2O⇌H2CO3+2OH-
|
|
| 13. | 详细信息 |
|
若将少量铝粉加入某溶液中,有氢气放出,则该溶液中一定能够大量共存的离子组是:( ) A. K+、Na+、 C. K+、Na+、[Al(OH)4]-、
|
|
| 14. | 详细信息 |
|
下列除去杂质的方法不正确的是 A. 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 B. 用过量氨水除去Fe3+溶液中的少量Al3+ C. 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 D. 铜中混有铁粉:加过量硫酸铜溶液后过滤
|
|
| 15. | 详细信息 |
|
下列各组物质相互混合反应后,最终有白色沉淀生成的是 ①金属钠投入FeCl3溶液中; ②过量NaOH溶液和明矾溶液混合; ③少量Ca(OH)2投入过量NaHCO3溶液中; ④向AlCl3溶液中滴入NaHCO3溶液; ⑤向饱和Na2CO3溶液中通入足量CO2 A. ①③④⑤ B. 只有①④ C. 只有②③ D. 只有③④⑤
|
|
| 16. | 详细信息 |
|
下列物质的制备方法正确的是 A. 氯化铝溶液和硫化钠溶液反应制备Al2S3 B. 用镁粉和空气反应制备Mg3N2 C. 用铝粉和MnO2制得锰 D. 用电解熔融氯化铝的方法制得单质铝
|
|
| 17. | 详细信息 |
|
下列物质放入水中发生化学反应,水做氧化剂的是( ) A. 钠 B. 氯气 C. 氧化钙 D. 过氧化钠
|
|
| 18. | 详细信息 |
|
下列说法正确的是( ) A. 冰醋酸、冰水混合物、钢、淀粉都属于混合物 B. 葡萄糖溶液与淀粉溶液的本质区别是有无丁达尔效应 C. 因为胶粒能吸附电荷,所以有的胶体带正电,有的胶体带负电 D. 雾、稀豆浆、烟水晶都属于胶体
|
|
| 19. | 详细信息 |
|
设NA为阿伏伽德罗常数的值。下列说法正确的是 A. 11g的D218O中含有的中子数为5NA B. 1L pH=2的H2SO3溶液中H+的数目为0.02NA C. 将0.1mol Cl2通入足量FeI2溶液中,转移电子数目为0.2NA D. 标准状况下,4.48L甲烷与足量Cl2完全反应生成CH3Cl的分子数目为0.2NA
|
|
| 20. | 详细信息 |
|
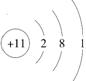
反应NH4Cl+NaNO2 A. 中子数为18的氯原子: B. N2的结构式:N=N C. Na+的结构示意图: D. H2O的电子式:
|
|
| 21. | 详细信息 |
|
下列有关说法正确的是( ) A. 卫生间洁厕灵和84消毒液(NaClO溶液)混合使用能增强它们的消毒效果 B. 气溶胶被认为可以传播新冠病毒,它是气体分散质分散到液体分散剂中的一种胶体 C. “熔喷布”可用于制作口罩,生产“熔喷布”的主要原料是聚丙烯,它属于混合物 D. 疫情期间可以多吃富含纤维素的食物,它们在人体内都可以通过水解反应提供能量
|
|
| 22. | 详细信息 |
|
化学与生活密切相关,下列有关说法错误的是( ) A. 商代后期制作 B. 战国时期最大铁器−−长方形铁炉,其主要成分是铁碳合金 C. 我国自主研发的C919大飞机,其外壳主要成分是硬铝合金 D. 制饭勺、高压锅所用的不锈钢是纯铁
|
|