2018吉林高二下学期人教版高中化学期中考试
| 1. | 详细信息 |
|
为表示一个原子在第三电子层上有10个电子,可以写成: A 3d10 B 3f10 C 3s23p63d2 D 3s23p64s2
|
|
| 2. | 详细信息 |
|
下列关于能层与能级的说法中正确的是: A、原子核外电子的每一个能层最多可容纳的电子数为2n2 B、任一能层的能级总是从s能级开始,而且能级数等于该能层序数 C、同是s能级,在不同的能层中所能容纳的最多电子数是不相同的 D、1个原子轨道里最多只能容纳2个电子,但自旋方向相反。
|
|
| 3. | 详细信息 |
|
外围电子构型为4d35s2元素在周期表中的位置是( ) A.第五周期第ⅡB族 B.第五周期第ⅤB族 C.第六周期第ⅦB族 D.第六周期第ⅢB族
|
|
| 4. | 详细信息 |
|
各周期包含的元素为( ) A、2、8、18、32、72、98 B、 2、8、8、18、18、32 C、2、8、8、18、32、32 D、 2、8、18、32、32、72
|
|
| 5. | 详细信息 |
|
某元素质量数51,中子数28,其基态原子未成对电子数为( ) A、0 B、1 C、 2 D、3
|
|
| 6. | 详细信息 |
|
具有下列电子排布式的原子中,不能形成 π 键的是( ) A.1s22s22p63s23p4 B.1s22s22p3 C.1s22s22p63s1 D.1s22s22p2
|
|
| 7. | 详细信息 |
|
在[Cu(NH3)4]2+配离子中NH3与中心离子Cu2+结合的化学键是 A.离子键 B.非极性键 C.极性键 D.配位键
|
|
| 8. | 详细信息 |
|
下列分子的中心原子是sp2杂化的是( ) A.PBr3 B.CH4 C.H2O D.BF3
|
|
| 9. | 详细信息 |
|
下列说法中错误的是:……………………………………( ) A、SO2 、SO3都是极性分子 B、在 C、元素电负性越大的原子,吸引电子的能力越强 D、原子晶体中原子以共价键结合,具有键能大,熔点高,硬度大的特点
|
|
| 10. | 详细信息 |
|
下列变化中释放能量的是( ) A.1s22s22p63s1—→1s22s22p6 B.N≡N(g)—→N(g)+N(g) C.2px22py12pz1—→2px12py12pz2 D.2H(g)—→H—H(g)
|
|
| 11. | 详细信息 |
|
在白磷(P4)分子中,4个P原子分别处在正四面体的四个顶点,结合有关P原子的成键特点,下列有关白磷的说法正确的是( ) A.白磷分子的键角为109°28′ B.分子中共有4对共用电子对 C.白磷分子的键角为60° D.分子中有6对孤电子对
|
|
| 12. | 详细信息 |
|
.下列各组物质中发生状态变化时所克服的粒子间的相互作用属于同种类型的是( ) A.食盐和氯化氢溶于水 B.氯化钠和硫熔化 C.碘和干冰升华 D.二氧化硫和氧化钠熔化
|
|
| 13. | 详细信息 |
|
干冰熔点很低是由于( ) A.CO2是非极性分子 B.C=O键的键能很小 C.CO2化学性质不活泼 D.CO2分子间的作用力较弱
|
|
| 14. | 详细信息 |
|
下列现象与氢键有关的是( ) ①NH3的熔、沸点比VA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④水分子高温下也很稳定 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 A、①②③④⑤ B、①②③⑤ C、①②③④ D、①②③
|
|
| 15. | 详细信息 |
|
下面有关离子晶体的叙述中,不正确的是…………………………. ..( ) A.1mol氯化钠中有NA个NaCl分子 B.氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 C.氯化铯晶体中,每个CS+周围紧邻8个Cl- D.平均每个NaCl晶胞中有4个Na+、4个Cl-
|
|
| 16. | 详细信息 |
|
有关原子最外层电子排布为(n+1)sn(n+1)P n+1的元素及其化合物,下列叙述中不正确的是:………………………………….( ) A、氢化物受热易分解 B、最高价氧化物对应的水化物是一种强酸 C、其单质既有氧化性又有还原性 D、是植物生长所需要的一种营养元素
|
|
| 17. | 详细信息 |
|
A、B、C、D、E代表5种元素。请填空: (1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素名称为 ; (2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,则它们形成化合物的化学式为 (3)D元素的正三价离子的3d能级为半充满,D的元素正三价离子符号为 , (4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为 。
|
|
| 18. | 详细信息 |
|
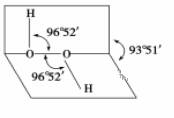
如图所示是过氧化氢(H2O2)分子的空间结构示意图。
(1)写出过氧化氢分子的电子式________。 (2)下列关于过氧化氢的说法中正确的是(填序号)____。 ①分子中有极性键 ②分子中有非极性键 ③氧原子的轨道发生了sp2杂化 ④O—O共价键是p—pσ键 ⑤分子是非极性分子 (3)过氧化氢分子之间易形成氢键,该氢键的表示式是____________。 (4)过氧化氢易溶于水,主要原因是________________________。 (5)Fe元素位于周期表的________分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为________;与CO分子互为等电子体的分子和离子分别为________和________(填化学式)。
|
|
| 19. | 详细信息 | ||||||||||||||||||||||||
|
有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这三种晶体进行实验,结果如下表所示:
(1)晶体的化学式分别为:A________,B________,C________。 (2)晶体的类型分别为:A________,B________,C________。 (3)晶体中粒子间的作用分别为:A________,B________,C________。
|
|||||||||||||||||||||||||
| 20. | 详细信息 |
|
随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为: ①将NaCl固体研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中。 ②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积为V cm3。 (1)步骤②中是用 滴定管,能否用水代替苯 , 理由是 。 (2)已知NaCl晶体中,靠得最近的Na+、Cl—间的距离为a cm (如上图),则用上述方法测得的阿佛加德常数NA的表达式为 。(相对原子质量 Na 23 ,Cl 35.5 )
|
|