2018湖北高三上学期人教版高中化学单元测试
| 1. | 详细信息 |
|
漆器是中华民族传统工艺的瑰宝,常以木材(炭)、金属为胎骨,在胎骨上层层髹红漆。漆的主要成分是含有15或17个碳原子的烷基邻苯二酚。下列说法不正确的是( ) A.收藏漆器工艺品应注意避免阳光暴晒 B.“钻石恒久远,一颗永流传”中的钻石和漆器中的木炭均由碳元素组成 C.铜做胎骨的漆器,掉漆后长时间放置,铜的表面仍能保持光亮 D.漆的烷基部分碳原子数越多越难溶于水
|
|
| 2. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
B.将1.5mol Cl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=3NA C.高温下,2 mol Fe与足量水蒸气反应,生成的H2分子数目为3NA D.标况下,11.2L的C2H4和C3H6混合气体,原子间形成的共用电子对数目为3NA
|
|
| 3. | 详细信息 |
|
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法不正确的是( ) A.该电池的实际能量利用率目前不可能达到90% B.电路中每转移6mol e-,消耗CH4的物质的量为1mol C.电池工作时,CO D.电极B上发生的电极反应为:O2+2CO2+4 e-=2 CO
|
|
| 4. | 详细信息 |
|
X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可形成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25 ℃时,0.1 mol/L X和W形成化合物的水溶液pH为1,下列说法正确的是( ) A.五种元素在自然界均能以游离态的形式存在 B.Y、Z、W三种元素组成化合物的水溶液可显碱性 C.HClO的电子式可表示为: D.Z、R、W的简单离子均可破坏水的电离平衡
|
|
| 5. | 详细信息 |
|
工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3:PbSO4(s) + CO32-(aq) A.PbSO4的溶解度小于PbCO3 B.处理PbSO4后,Na2CO3或NaHCO3溶液的pH升高 C.若用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大 D.整个过程涉及一个复分解反应和两个氧化还原反应
|
|
| 6. | 详细信息 |
|
下列有关实验原理的说法中正确的是( ) ①向铜锌稀硫酸原电池中加入K2Cr2O7或高锰酸钾晶体或10%H2O2会增强原电池的放电效率 ②在试管中加入3~5ml稀盐酸,再用胶头滴管逐滴加入Na2SiO3溶液,即可制得硅酸胶体。 ③在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 ④用标准酸液、甲基橙试液、pH计、滴定管(酸式和碱式)、锥形瓶、蒸馏水等主要仪器和药品即可完成某一未知浓度氨水电离程度的测定实验 A.①② B.③④ C.①④ D.②③
|
|
| 7. | 详细信息 |
|
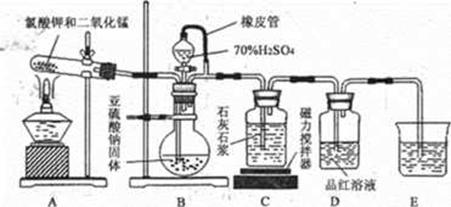
石灰石—石膏法脱硫是除去工业烟气中所含SO2的重要方法,其工艺分为两步: —是吸收产生亚硫酸氢钙,二是氧化产生石膏。某校化学兴趣小组实验模拟该工艺,设计装置如下:
(1)装置B模拟产生含SO2的工业烟气,则E装置的作用是_______________________。 (2)实验开始时,打开装置B中分液漏斗的活塞,向烧瓶中逐滴滴加硫酸,D中立即产生了明显的现象,造成产生这一现象的原因是_______。 A.该装置的气密性不够好 B.滴加硫酸的速率较快 C.使用的硫酸浓度较小 D.石灰石浆液中碳酸钙粉末的顆粒太小 (3)预计当装置C中产生__________________的现象时,关闭装置B中分液漏斗的活塞,再点燃装置A处的酒精灯。实际实验过程中却始终未观察到C中产生这一现象,小组成员多次逬行实验探究,最终发现是药品Na2SO3部分变质,请写出定性实验发现药品Na2SO3问题的有关操作及现象:取少量的亚硫酸钠固体于试管中, 先加适量的水溶解,再加入足量的盐酸与氯化钡溶液,有白色沉淀生成。 (4)小组成员进一步定量实验,测量Na2SO3的纯度: ①称取12.0 g Na2SO3固体配成l00 mL溶液,取25.00mL于锥形瓶中,并加入几滴淀粉溶液。 ②用0.1000 mol •L-1酸性KIO3溶液滴定,三次平行实验测得标准液的体积为20.00mL。 写出刚开始滴加酸性KIO3溶液时亚硫酸钠被氧化的离子方程式:_______________________________;滴定终点时锥形瓶中产生的现象为________________________________________________________,写出与产生终点现象有关反应的离子方程式______________________________________,样品中Na2SO3的质量分数为_________。(计算结果保留三位有效数字)。
|
|
| 8. | 详细信息 |
|
Ⅰ、在工业上常用CO与H2合成甲醇,热化学方程式为 CO(g)+2H2(g) 已知: ①1/2O2(g)+CO(g) ②H2(g)+ 1/2O2(g) ③CH3OH(g)+ 3/2O2(g) 回答下列问题: ⑴a= ⑵已知由CO2生成CO的化学方程式为CO2(g)+O(g) ⑶在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g)
图一 图二 ①当起始n(H2)/n(CO) =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)= 。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4mol,达到新平衡时H2的转化率将 (填”增大“”减小“或”不变“)。 ②当n(H2)/n(CO) =3.5时,达到平衡后,CH3OH的体积分数可能是图像中的 (填“D”“E”或“F”)点。 ⑷在一容积可变的密闭容器中充有10mol CO和20mol H2。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图二所示。 ① A、B、C三点的平衡常数KA、KB、KC的大小关系为 。 ② 若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 ______ L。
|
|
| 9. | 详细信息 |
|
一种回收并利用含碘(I-)废液的工艺流程如下:
(1)“沉淀”中生成CuI的离子方程式为 。
(2) CuSO4的投加量对废水中I-的去除量影响较大,不同投加量(用过量系数表示)下,反应后I-和Cu2+的浓度如上图所示,则适宜的CuSO4过量系数应为 ,分析原因 _______________________ 。 (3) 滤渣转化为碘单质的化学方程式为 ,反应Ⅰ中生成铁与碘的化合物(其中铁与碘的质量比为21:127),则加入的水的作用是_______,反应Ⅱ的化学方程式是 。 (4) 操作Ⅰ包括 、 、过滤。
|
|
| 10. | 详细信息 |
|
卤素及其化合物广泛存在于自然界中。回答下列问题: ⑴光气是一种重要的有机中间体,在农药、医药、工程塑料、聚氨酯材料以及军事上都有许多用途。光气(COCl2)的分子立体构型为______________,其三种元素的电负性由小到大的顺序为________。与COCl2互为等电子体的分子和离子__________(各写一种)。 ⑵25时,1体积的水可溶解约2体积的氯气,而1体积的水可溶解约500体积的HCl,其原因是_________________________________________。 ⑶卤化物中NaCl和CsCl为典型的离子晶体,其熔点NaCl______CsCl (填“大于”、“等于”或“小于”)。 ⑷偏高碘酸(HIO4)可以通过真空加热正高碘酸(H5IO6)脱水而得到。①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为_______(填序号)。 ⑸氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图一),a位置上Cl原子的杂化轨道类型为 ;某同学将基态铜原子价电 ⑹一种铜的溴化物晶胞结构如图二所示。有关说法正确的是 (填序号)。 a.该化合物的化学式为CuBr2 b.铜的配位数为8 c.与每个Br紧邻的Br有12个 d.由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为( e.若图中P点和R点的原子核间距为a cm,NA为阿伏伽德罗常数的值,则该晶胞密度为
|
|
| 11. | 详细信息 |
|
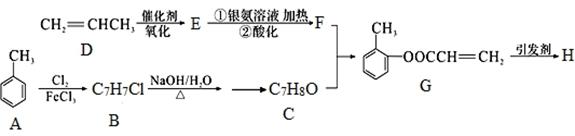
高分子 H 是有机合成工业中一种重要的中间体。以丙烯和甲苯为起始原料合成 H 的工艺流程如下:
回答下列问题: (1) 化合物 E 中的官能团名称是____________ 。由 G 反应生成 H 的反应类型是 __________。 (2)写出 E 与银氨溶液共热的离子反应方程式:________________________________。 (3)A 分子内在同一平面最多的原子有_______个。 (4)写出 C 与 F 反应生成 G 的化学方程式:___________________________________。 (5)符合下列条件的 G 的同分异构体有_______种:①与 G 具有相同的官能团 ②能够发生水解,水解产物与 FeCl3 溶液发生显色反应 ③苯环上有两个取代基.其中核磁共振氢谱峰面积比为 1∶2∶2∶2∶1∶2 的是 (填结构简式):_________________。
|
|