2019上海高一下学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
你认为减少酸雨可采取的措施是( ) ①少用煤作燃料 ②把工厂的烟囱造高 ③燃料脱硫 ④开发新能源 A. ①②③ B. ②③④ C. ①③④ D. ①③
|
|
| 2. | 详细信息 |
|
下列有关硫及其化合物的叙述正确的是( ) A. 硫单质是一种淡黄色易溶于水的固体 B. SO2的漂白原理与活性炭相同 C. 可用澄清石灰水鉴别SO2和CO2 D. 可用铁质或铝制容器储存浓硫酸
|
|
| 3. | 详细信息 |
|
飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降。它与空气中的SO2、O2接触时,SO2会部分转化为SO3,使空气的酸度增加。飘尘所起的作用可能是( ) A. 氧化剂 B. 还原剂 C. 催化剂 D. 吸附剂
|
|
| 4. | 详细信息 |
|
不能由单质直接与O2反应生成的氧化物是( ) A. Fe3O4 B. NO2 C. SO2 D. CuO
|
|
| 5. | 详细信息 |
|
下列关于硫酸的叙述中,正确的是( ) A. 浓硫酸具有吸水性,因而能使蔗糖炭化 B. 浓硫酸具有氧化性,稀硫酸无氧化性 C. 浓硫酸是一种干燥剂,能够干燥碘化氢、氢气等气体 D. 稀释浓硫酸时,应将其沿着器壁慢慢加入到水中,并用玻璃棒不断搅拌
|
|
| 6. | 详细信息 |
|
下列俗名与化学式对应的是( ) A. 石膏:CaSO4·2H2O B. 碳铵:(NH4)2CO3 C. 重晶石:BaCO3 D. 芒硝:Na2SO4·12H2O
|
|
| 7. | 详细信息 |
|
下列溶液中能够区别SO2和CO2气体的是( ) ①澄清石灰水 ②H2S溶液 ③KMnO4溶液 ④品红溶液 A. ①②③ B. ①③④ C. ②③④ D. ①②③④
|
|
| 8. | 详细信息 |
|
硫元素的非金属性弱于氯元素的事实是( ) A. 通常情况下硫为浅黄色固体,而氯气为黄绿色的气体 B. 硫不溶于水而氯气溶于水 C. 跟金属或氢气反应时,硫被还原为 D. 跟Cu或Fe反应时,金属被硫氧化成低价态,而被氯氧化成高价态
|
|
| 9. | 详细信息 |
|
在某BaCl2溶液中通入SO2气体,未见沉淀生成;若先通入SO2气体,再通入另一种气体,则可看到沉淀生成;这种气体不可能是( ) A. Cl2 B. NH3 C. HCl D. SO3(气体)
|
|
| 10. | 详细信息 |
|
有关氨的性质的叙述中不正确的是( ) A. 氨气在一定条件下能被O2氧化 B. 氨水显碱性 C. 氨气极易液化 D. 将蘸有浓氨水的玻璃棒和蘸有酸(浓溶液)的玻璃棒靠近都能产生白色烟雾
|
|
| 11. | 详细信息 |
|
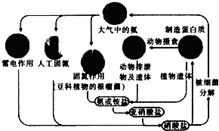
下列有关自然界中氮循环(如右图)的说法不正确的是( )
A. 含氮无机物和含氮有机物可相互转化 B. 通过闪电产生NO属于固氮 C. 硝酸盐被细菌分解为氮气过程,氮元素一定被氧化 D. C、H、O也参与自然界中氮循环
|
|
| 12. | 详细信息 |
|
盛有NO和NO2的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半.则原混合气体中NO和NO2的体积比是( ) A. 3:1 B. 1:3 C. 2:1 D. 1:2
|
|
| 13. | 详细信息 |
|
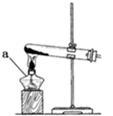
用图所示实验装置探究钢丝与过量浓硫酸的反应。下列描述不合理的是( )
A. 该反应中浓硫酸表现了强氧化性和酸性 B. ②中选用品红溶液验证SO2的生成 C. ③中选用NaOH溶液吸收多余的SO2 D. 为确认CuSO4生成,向①中加水,观察颜色
|
|
| 14. | 详细信息 |
|
鉴别NO2和Br2蒸气,下列实验不可行的是( ) A. 溶于水 B. 通入CCl4 C. 通入NaOH溶液 D. 通入AgNO3溶液
|
|
| 15. | 详细信息 |
|
在A+2B A. v(A)=0.3mol/(L·s) B. v(B)=0.5mol/(L·s) C. v(C)=0
|
|
| 16. | 详细信息 |
|
可以充分说明反应P(g)+Q(g) A. 反应容器内的压强不随时间改变 B. 反应容器内P、Q、R、S四者浓度之比为1:1:1:1 C. P的生成速率和S的生成速率相等 D. 反应容器内的气体总物质的量不随时间变化
|
|
| 17. | 详细信息 |
|
对于以下反应:A(s)+3B(g) A. 当容器内的压强不再变化,可以判断反应已经达到平衡 B. 往容器中通入稀有气体He,由于压强增大,所以反应速率增大 C. 往容器中加入少量A,反应速率增大 D. 若反应是放热反应,升高温度,正反应速率增大
|
|
| 18. | 详细信息 |
|
投入一定量的物质A和B发生可逆反应:2A(g)+nB(g)
A. n+2<m该反应正反应为放热反应 B. n+2<m该反应正反应为吸热反应 C. n+2>m该反应正反应为放热反应 D. n+2>m该反应正反应为吸热反应
|
|
| 19. | 详细信息 |
|
对已达平衡状态的反应:2X(g)+Y(g) A. 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 B. 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 C. 正、逆反应速率都减小,平衡向逆反应方向移动 D. 正、逆反应速率都增大,平衡向正反应方向移动
|
|
| 20. | 详细信息 |
|
工业上合成氨时一般采用500℃左右的温度,其原因是( ) ①适当提高氨的合成速率;②提高H2的转化率;③提高氨的产量;④催化剂在500℃时的活性最大 A. 只有④ B. ①② C. ①③④ D. ①④
|
|
| 21. | 详细信息 |
|
含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-2、0、+4、+6四种,其不同价态的物质间可相互转化,完成下列填空: (1)写出硫与铁反应的化学方程式_____________________,所得产物的颜色为_________。 (2)将硫化氢气体与二氧化硫气体在集气瓶中混合发生反应,现象是___________,硫化氢呈现______(选填“氧化性”、“还原性”)。 (3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是_________。 (4)硫酸盐的种类很多,且应用广泛,医疗上采用____作X射线透视肠胃的内服药剂。
|
|
| 22. | 详细信息 |
|
氮元素在生命活动中扮演着十分重要的角色,回答下列与氮及其化合物有关的问题。 (1)为了提高农作物的产量,德国化学家哈伯、波施等科学家成功地开发了将氮气转化为氨气的生产工艺,请用化学方程式表示工业合成氨的反应原理____________;为什么选择20~50Mpa的高压?说明理由______________________________________________________________。 (2)氨气通入水中可制得氨水,氨水能使无色的酚酞变红,请用电离方程式表示其原因:_________________________________________________。
|
|
| 23. | 详细信息 |
|
在一固定容积的密闭容器中,进行反应:C(s)+H2O(g) 完成下列填空: (1)若容器容积为2L,反应10s氢气质量增加0.4g,则该时间内一氧化碳的反应速率为_________。 (2)若增加碳的量,则正反应速率________(选填“增大”、“减小”、“不变”)。 (3)该反应达到平衡状态的标志是_______(选填编号)。 a 压强不变 b (4)若升高温度,平衡向右移动,则正反应是______反应(选填“吸热”或“放热”)。
|
|
| 24. | 详细信息 |
|
亚硫酸钠是工业上常用的还原剂,容易被空气氧化成硫酸钠。检验亚硫酸钠样品中是否含有硫酸钠的方法是:取少量亚硫酸钠样品溶于水,然后_______________________________________。
|
|
| 25. | 详细信息 |
|
(1)常温下,2L pH=12的Ba(OH)2溶液的物质的量浓度为________,从中取出10mL加水稀释到100mL,pH=______。 (2)已知500mLAl2(SO4)3溶液中含有Al3+为0.5mol,则Al2(SO4)3溶液的物质的量浓度为____mol/L,取上述溶液50mL加水到150mL,此溶液中SO42-的物质的量浓度为_____mol/L。
|
|
| 26. | 详细信息 |
|
实验室要配制100mL 2mol/L NaCl溶液,请回答下列问题: (1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管和__________。 (2)用电子天平称取氯化钠固体,其质量为____g。 (3)下列主要操作步骤的正确顺序是______(填序号)。 ①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解; ②加水至液面刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切; ③将溶液转移到容量瓶中; ④盖好瓶塞,反复上下颠倒,摇匀; ⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。 (4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度______(填“偏高”或“偏低”或“无影响”,下同);若定容时俯视容量瓶刻度线,会造成所配溶液的物质的量浓度______。
|
|
| 27. | 详细信息 |
|
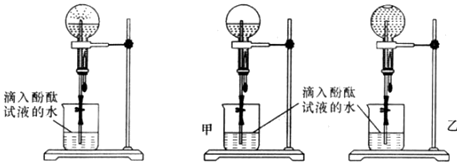
实验室有如图所示的实验装置: A (1)已知氮气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水,在实验室中通常用加热固体氯化铵和氢氧化钙的混合物来制取氨气。试回答下列问题: ①实验室制取氨气可以选用________装置,收集氨气可以选用________装置。 ②试写出实验室制取氨气的化学方程式:____________________________________。 ③如何检验收集的气体是氨气?试写出方法和结论:__________________________。 (2)甲、乙两组同学用干燥的圆底烧瓶各收集一瓶氨气,根据图B喷泉实验的装置进行实验,都观察到美丽的红色喷泉。
图B:喷泉实验装置 图C:两组实验结果对比 根据实验现象说明氨气具有的性质是___________、____________。 (3)甲、乙两组同学完成喷泉实验后,圆底烧瓶中所得溶液如图C所示。请通过分析确认:甲组同学所得氨水的物质的量浓度_______(填“大于”、“小于”或“等于”)乙组同学所得氨水的物质的量浓度。
|
|

 C
C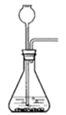 D
D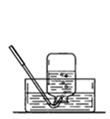 E
E